Incrustar presentación
Descargar como ODP, PPTX
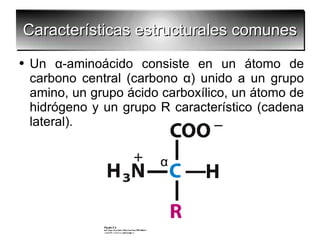
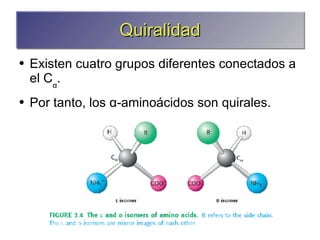
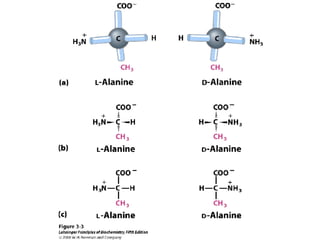

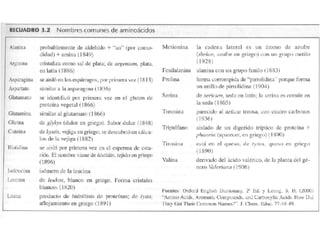



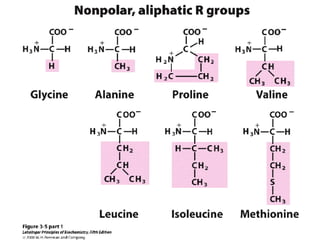
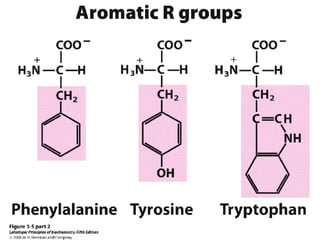
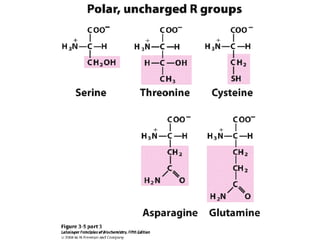
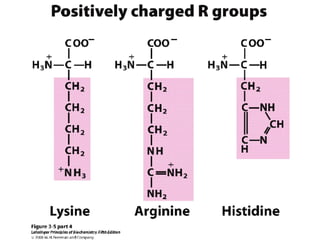
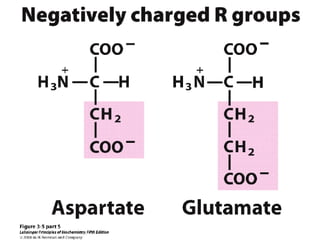

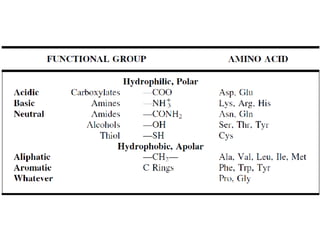

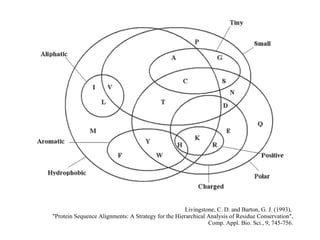

Los aminoácidos son los bloques estructurales de las proteínas. Un aminoácido consiste en un átomo de carbono central unido a un grupo amino, un grupo ácido carboxílico, un átomo de hidrógeno y una cadena lateral variable. Los aminoácidos son quirales debido a los cuatro grupos diferentes unidos al carbono central. En las proteínas se encuentran habitualmente 20 tipos distintos de cadenas laterales. Los seres humanos no pueden sintetizar nueve aminoácidos esenciales que deben obtener de su dieta

















