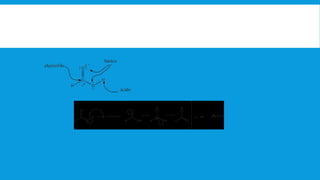
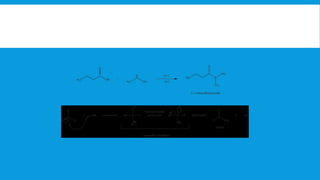
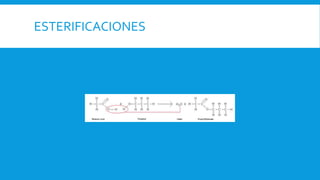
Los ácidos carboxílicos tienen como fórmula general R-COOH y propiedades ácidas. Son ácidos débiles que se disocian en agua para dar iones hidrógeno y aniones carboxilato. Pueden sintetizarse por oxidación de aldehídos y alcoholes, así como por reacciones de hidrocarboxilación y carbonilación. Forman sales al reaccionar con bases y pueden convertirse en amidas mediante deshidratación.