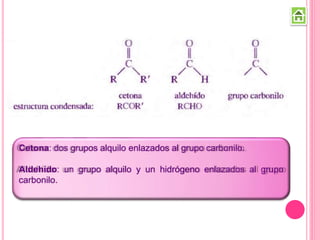
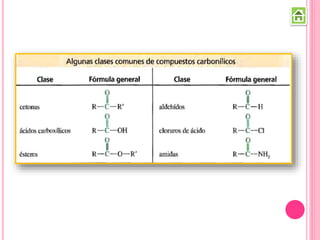
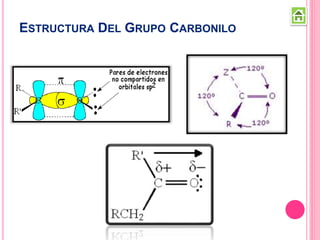
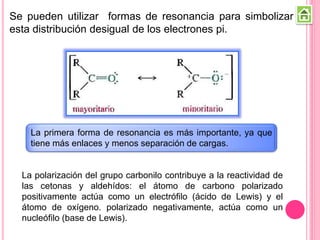
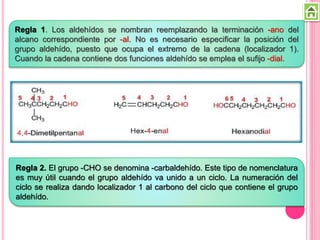
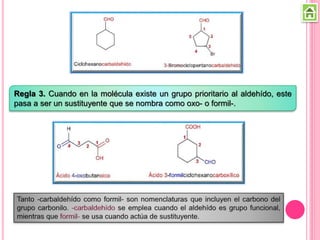
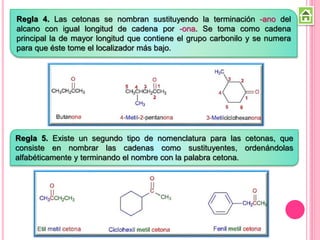
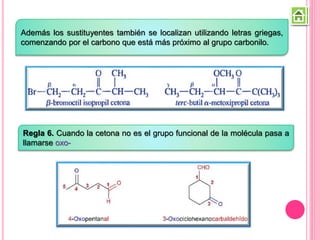
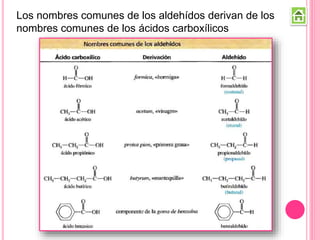
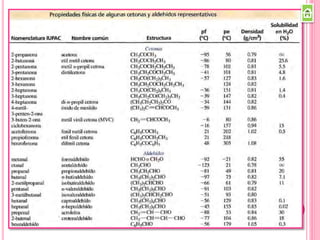
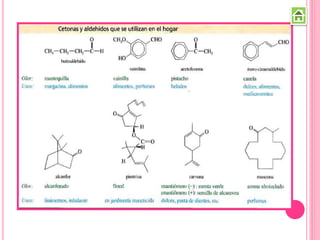
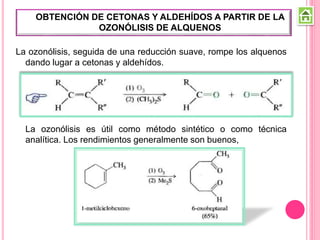
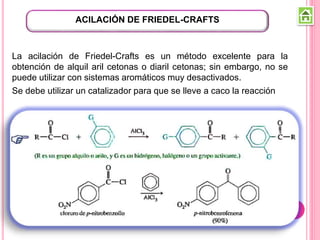
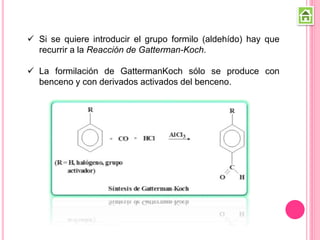
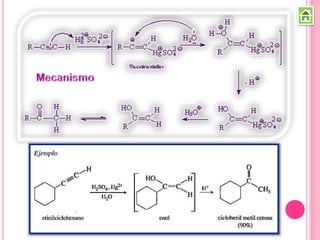
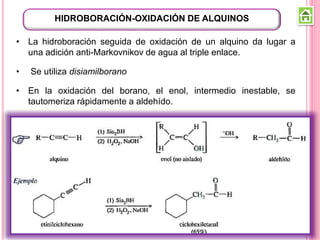
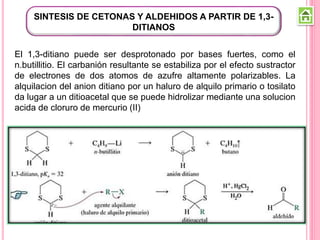
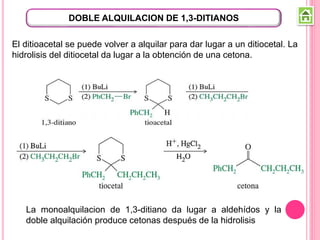
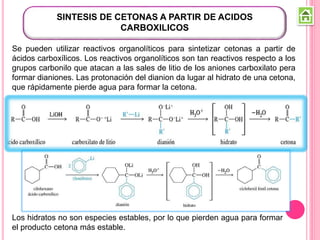
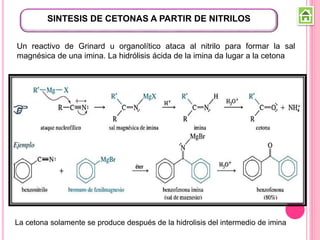
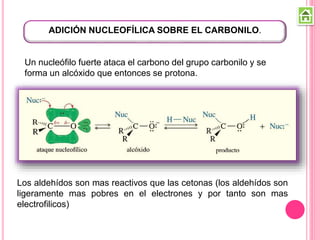
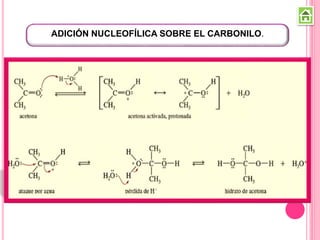
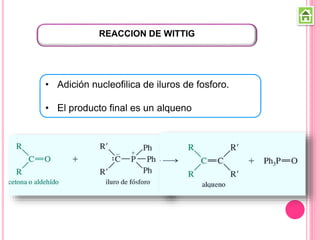
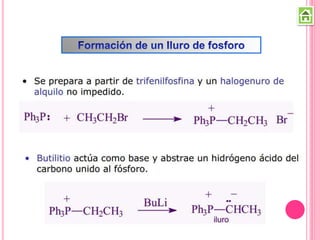
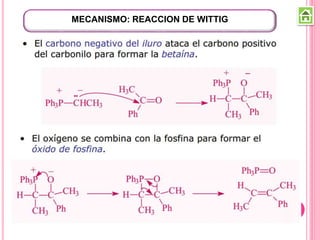
Los compuestos carbonílicos más simples son las cetonas y aldehídos. Las cetonas tienen dos grupos alquilo unidos al carbono carbonilo, mientras que los aldehídos tienen un grupo alquilo y un hidrógeno.
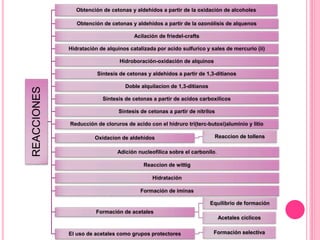
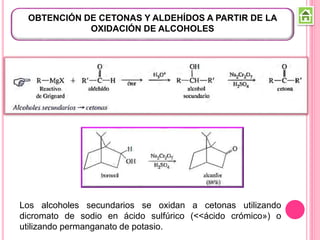
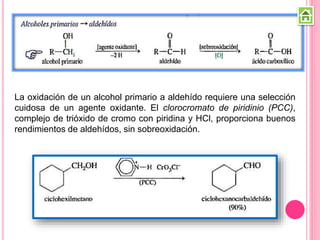
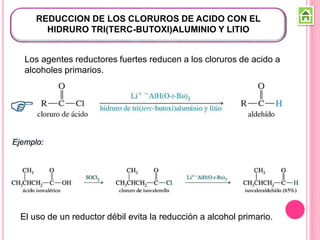
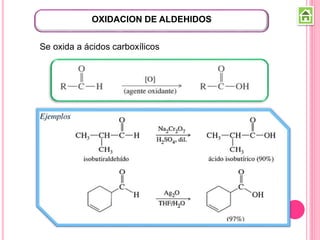
Existen varios métodos para sintetizar cetonas y aldehídos, como la oxidación de alcoholes, la ozonólisis de alquenos, y la acilación de Friedel-Crafts. También se pueden obtener a partir de ácidos carboxílicos