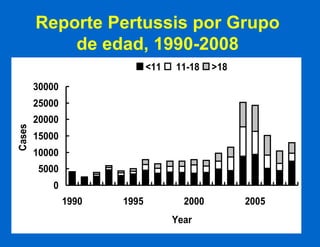
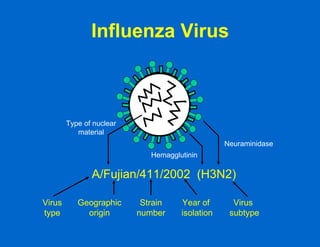
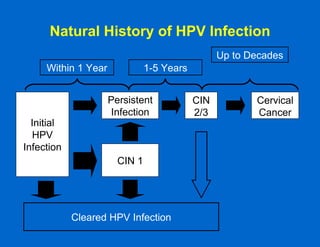
Este documento resume las principales vacunas recomendadas para adultos, incluyendo vacunas contra el tétanos, difteria, tos ferina, influenza, neumococo, herpes zoster, virus del papiloma humano, hepatitis A y B, sarampión, paperas, rubéola, varicela y meningococo. Describe los tipos de vacunas, esquemas de vacunación, indicaciones, eficacia y reacciones adversas para cada una. También señala que una de las razones por las que los adultos no se vacunan adecuadamente es porque