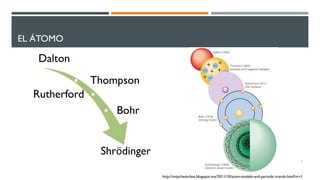
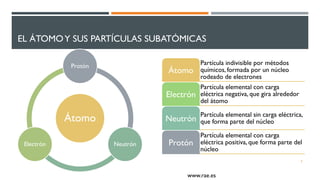
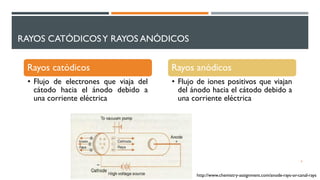
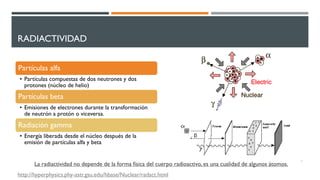
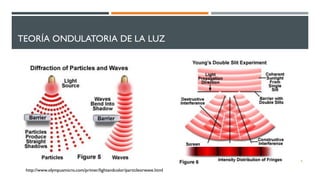
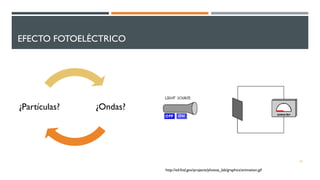
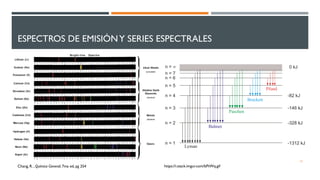
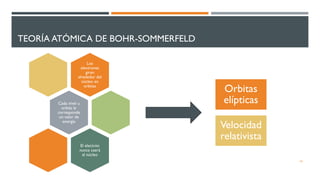
1) El documento presenta los conceptos fundamentales de la teoría cuántica y la estructura atómica, incluyendo las partículas subatómicas, las bases experimentales de la teoría cuántica, y las teorías de Bohr, de Broglie, Heisenberg y Schrödinger.
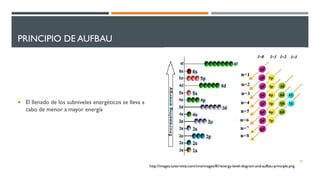
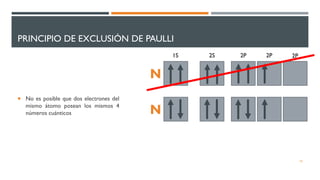
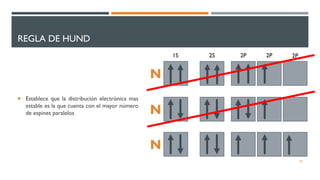
2) Explica los principios de Aufbau, exclusión de Pauli y máxima multiplicidad de Hund para la distribución electrónica en sistemas polielectrónicos.
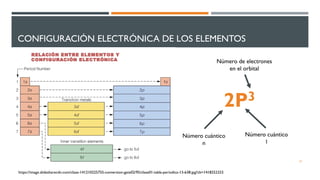
3) Describe la configuración electrónica