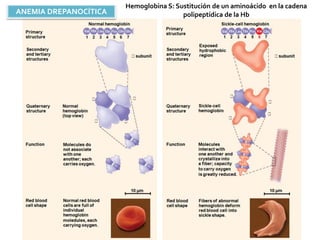
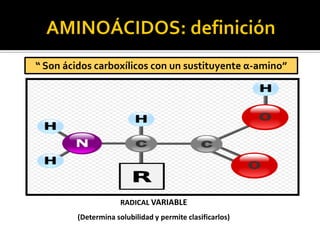
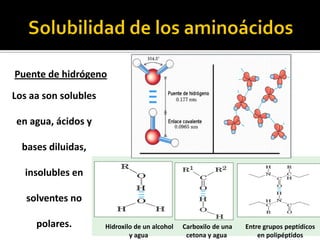
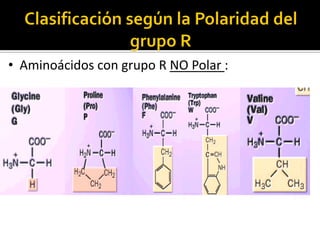
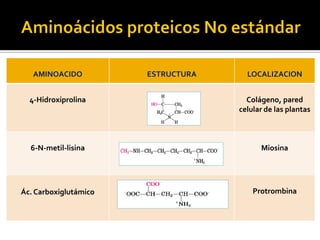
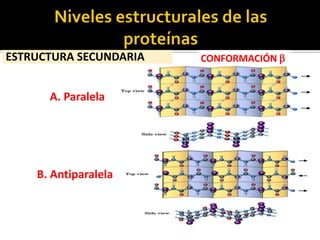
Este documento describe las propiedades y clasificación de los aminoácidos. Explica que los aminoácidos son los bloques de construcción de las proteínas y están compuestos por un grupo amino, un grupo carboxilo y una cadena lateral variable. Los clasifica en aminoácidos estándar esenciales y no esenciales, y no estándar. También describe las estructuras secundarias como las alfa hélices y plegamientos beta, así como proteínas importantes como la queratina, colágeno y proteínas con grupos prostéticos































![pH < pKa [Ácido] > [Base]
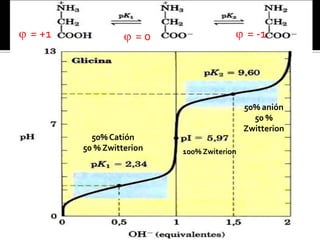
pH = pKa [Ácido] = [Base]
pH > pKa [Ácido] < [Base]
-COOH H+ + COO-
-NH3
+ H+ + NH2](https://image.slidesharecdn.com/unidadi-140626070829-phpapp02/85/Unidad-1-36-320.jpg)
![DEFINICIÓN
Es la transformación logarítmica de la expresión para la constante de
disociación.
Calcular el valor de pK´ de cualquier ácido, conociendo la
relación molar de las especies dadoras y aceptoras de protones
a un pH determinado.
FINALIDAD
pH = pK + log [A-]
[HA]](https://image.slidesharecdn.com/unidadi-140626070829-phpapp02/85/Unidad-1-37-320.jpg)


![COOH COO-
Grupo -carboxílico
pH < pKa [COOH] > [COO-]
pH = pKa [COOH] = [COO-]
pH > pKa [COOH] < [COO-]
Ácida Básica
NH3
+ NH2
Grupo -amino
pH < pKa [NH3
+] > [NH2]
pH = pKa [NH3
+] = [NH2]
pH > pKa [NH3
+] < [NH2]
Ácida Básica](https://image.slidesharecdn.com/unidadi-140626070829-phpapp02/85/Unidad-1-40-320.jpg)





































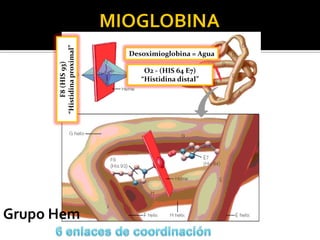
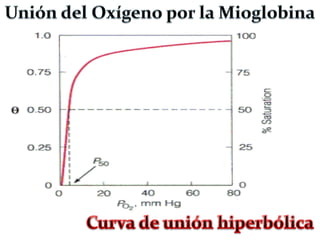








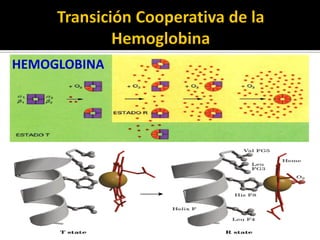





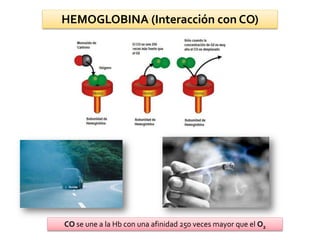
![HEMOGLOBINA (Efectos Alostéricos)
pO2 ↑
pCO2 ↓ pH↑
[BPG] ↓
pO2 ↓
pCO2 ↑ pH ↓
[BPG] ↑
4 O2 + HbT*BPG HbT*(O2)4 + H+ + BPG
FormaT de la
desoxihemoglobina
Forma R de la
oxihemoglobina](https://image.slidesharecdn.com/unidadi-140626070829-phpapp02/85/Unidad-1-96-320.jpg)