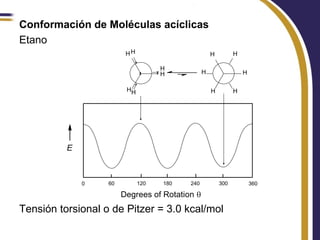
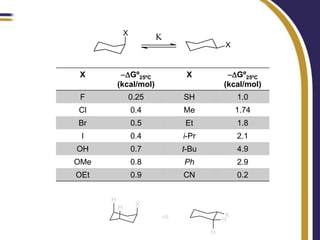
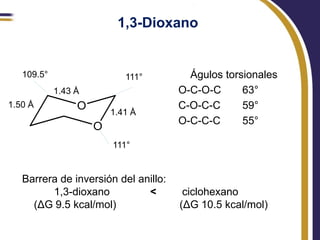
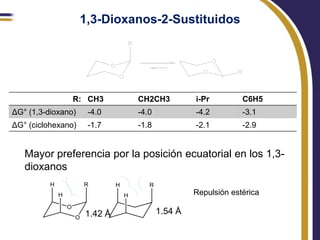
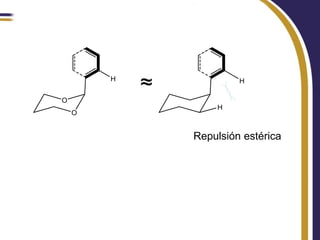
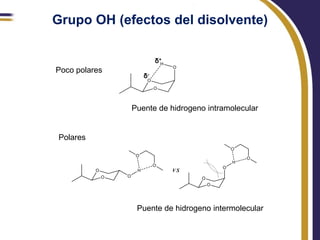
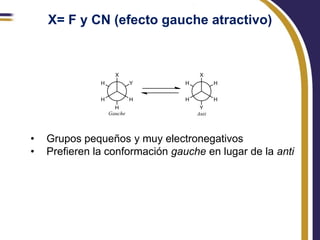
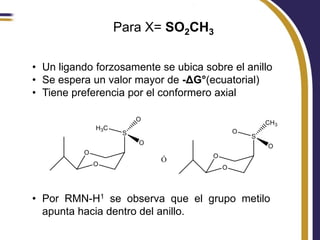
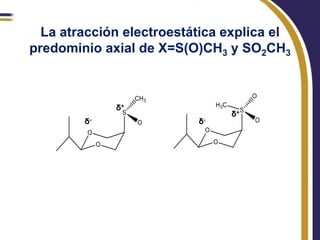
Este documento trata sobre el análisis conformacional de moléculas. Explica que las moléculas pueden adoptar diferentes conformaciones debido a la rotación de enlaces simples. Analiza las barreras energéticas entre los distintos conformeros y cómo afectan factores como la sustitución. También compara el análisis conformacional de cicloalcanos y heterociclos como el 1,3-dioxano, y estudia cómo influyen grupos funcionales polares en la estabilidad de los conformeros.