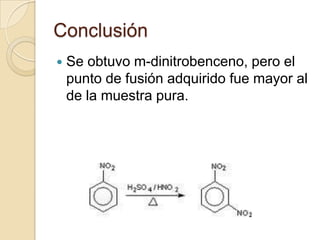
El documento describe un procedimiento para sintetizar m-dinitrobenceno a partir de nitrobenceno mediante nitración con ácido sulfúrico y ácido nítrico. El objetivo es obtener m-dinitrobenceno dentro de un rango de pureza aceptable determinado por su punto de fusión. Se lleva a cabo la reacción a alta temperatura y se realizan pasos de filtración, lavado y recristalización para purificar el producto, aunque el punto de fusión obtenido es mayor al de la muestra pura.