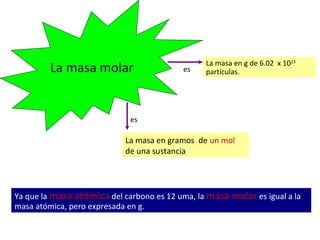
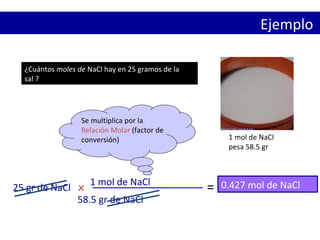
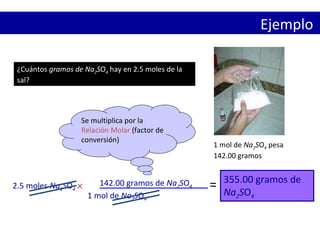
Este documento presenta conceptos clave sobre el mol y la cantidad de sustancia. Explica que un mol representa 6.02 x 1023 partículas elementales y que la masa de un mol de cualquier sustancia es numéricamente igual a su peso molecular en gramos. También cubre cómo calcular la cantidad de moléculas, átomos o fórmulas unitarias en una cantidad dada de una sustancia usando la relación molar.