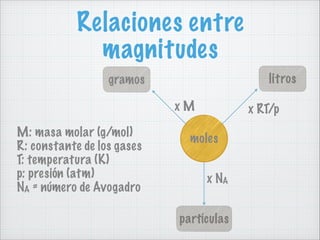
Este documento trata sobre la cantidad de sustancia, las masas atómicas y moleculares, y el mol. Explica que las masas atómicas se establecieron en relación a la masa del átomo de hidrógeno, y que el número de Avogadro indica el número de partículas elementales en una masa dada de sustancia. También define el mol como la cantidad de sustancia que contiene 6,022x1023 partículas o cuya masa coincide con la masa atómica expresada en gramos.