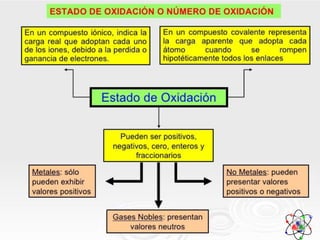
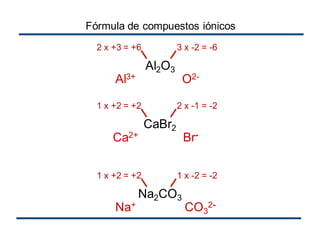
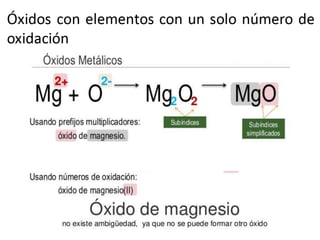
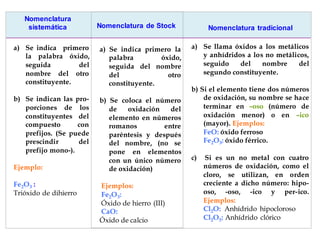
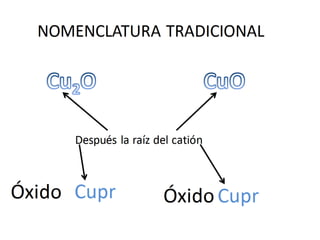
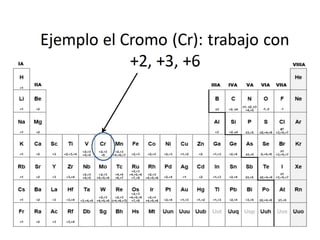
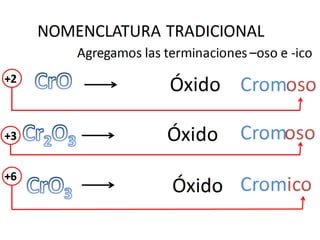
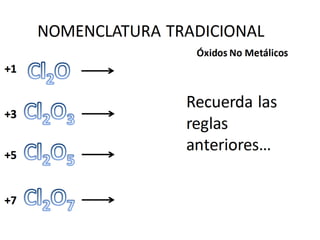
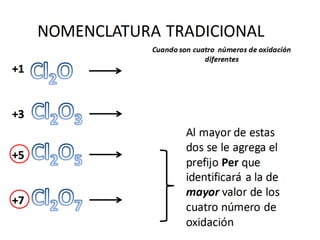
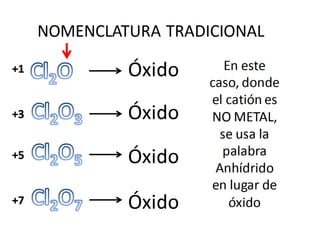
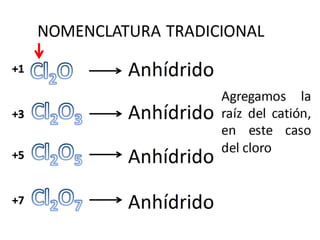
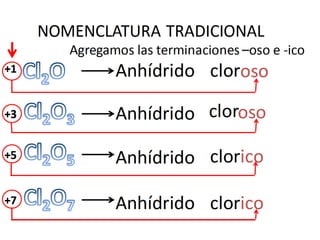
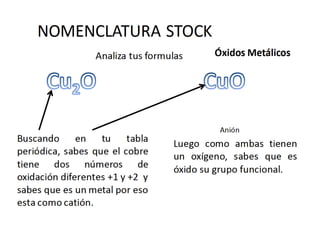
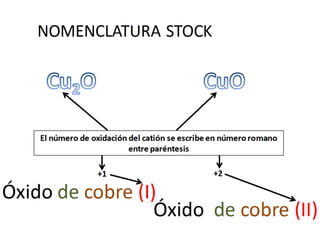
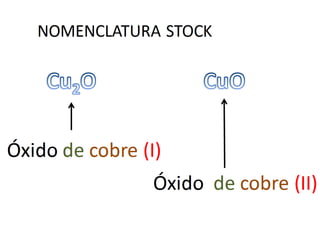
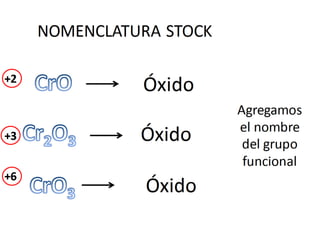
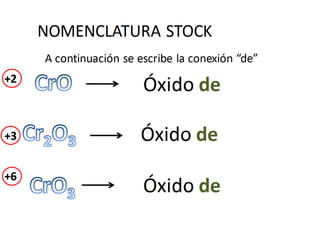
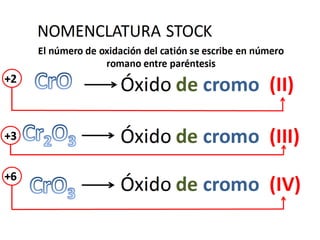
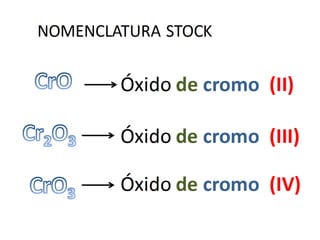
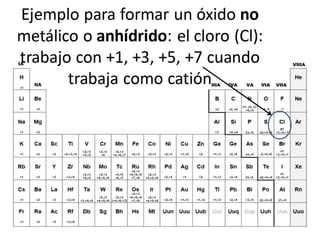
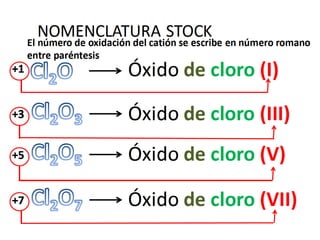
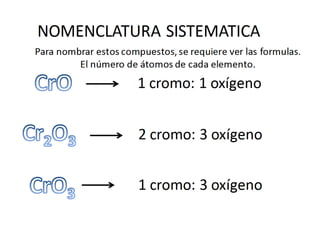
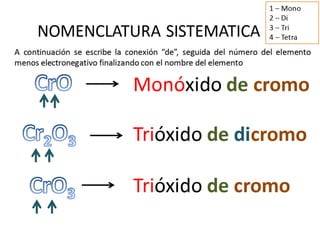
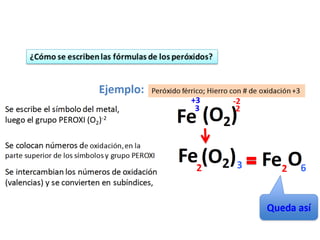
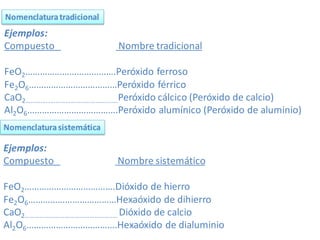
El documento habla sobre la nomenclatura de los óxidos. Explica que los óxidos son compuestos binarios formados por oxígeno combinado con otro elemento. Los óxidos se dividen en óxidos metálicos y no metálicos. También cubre las diferentes formas de nombrar los óxidos usando la nomenclatura sistemática, de Stock y tradicional, y cómo se aplican cuando los elementos tienen múltiples números de oxidación.