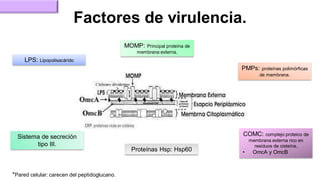
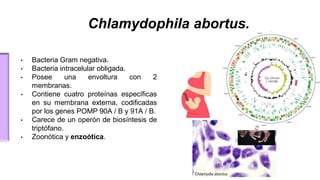
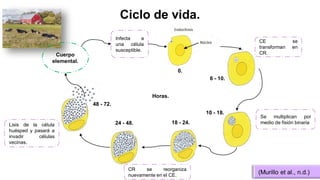
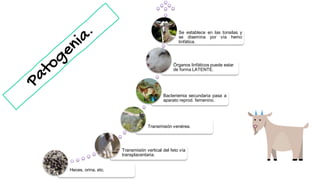
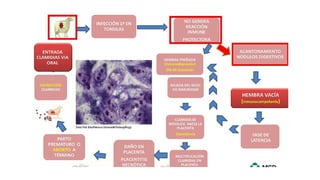
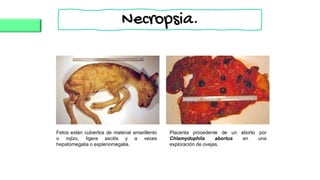
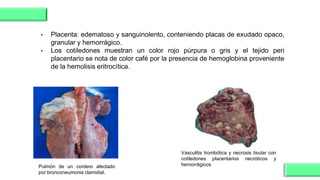
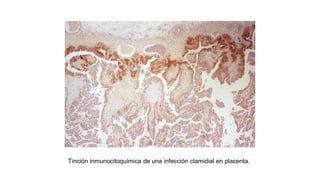
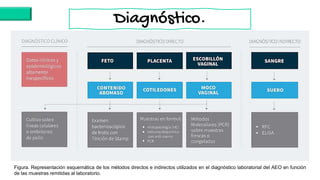
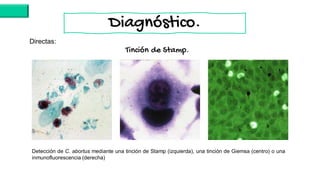
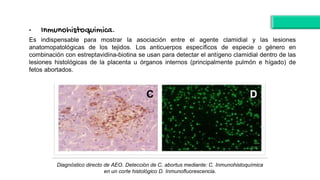
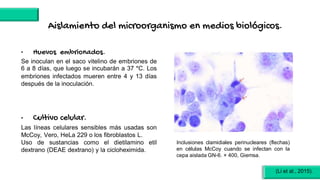
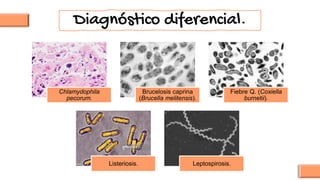
El documento proporciona información sobre Chlamydophila abortus, la bacteria que causa el aborto enzoótico ovino. Algunos puntos clave son: C. abortus es una bacteria intracelular obligada que infecta ovejas, cabras y otros pequeños rumiantes y puede causar abortos, disminución de la fertilidad y neumonía; se transmite entre animales a través del contacto directo o indirecto con fluidos de abortos o partos; el diagnóstico puede realizarse mediante pruebas directas como tinción, cultivo o PCR e indirectas