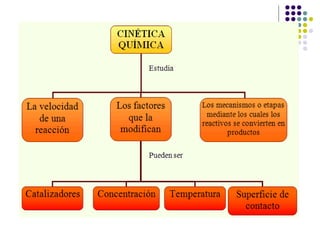
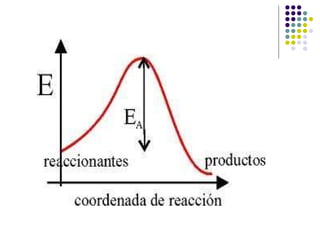
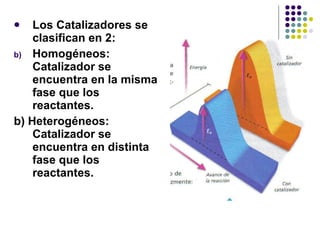
1) La cinética química estudia la velocidad de las reacciones químicas y los factores que la controlan. 2) La velocidad de reacción depende de la concentración de los reactivos y la energía de activación requerida. 3) Factores como la temperatura, concentración, estado de división y catalizadores afectan la velocidad al modificar la energía de colisión de las moléculas.


![Velocidad de Reacción Cantidad de reactivo que se consume o la cantidad de producto que se forma, en una unidad de tiempo determinado. La cantidad de sustancia se debe expresar en unidades de concentración [ ]](https://image.slidesharecdn.com/cintica-110705200809-phpapp02/85/Cinetica-4-320.jpg)

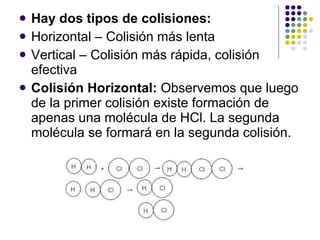
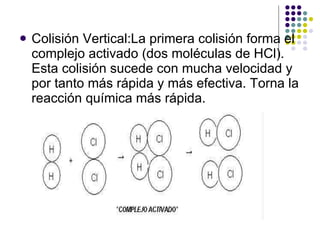



![2. Concentración La velocidad de R(X)aumentará si elevamos la [ ] de uno de los reactivos, ya que el n° de choques entre atomos es más frecuente. Si se duplica la [Reactivos], la velocidad de la reacción tambien se duplica.](https://image.slidesharecdn.com/cintica-110705200809-phpapp02/85/Cinetica-13-320.jpg)


![Expresión de Velocidad: I 2 (g) + H 2 (g) ------- 2 HI(g) V = K [ I 2 ] [ H 2 ] a [ I 2 ] = 1 ; ß [ H 2 ] = 1 Orden de la Reacción (a + ß) es 2 (Reacción de Segundo Orden)](https://image.slidesharecdn.com/cintica-110705200809-phpapp02/85/Cinetica-18-320.jpg)




![Variaciones en el equilibrio [reactivos] > 0 [reactivos] < 0 [productos] > 0 [productos] < 0 T > 0 (exotérmicas) T > 0 (endotérmicas) T < 0 (exotérmicas) T < 0 (endotérmicas) p > 0 Hacia donde menos nº moles de gases p < 0 Hacia donde más nº moles de gases MUY IMPORTANTE MUY IMPORTANTE Variación en el equilibrio](https://image.slidesharecdn.com/cintica-110705200809-phpapp02/85/Cinetica-23-320.jpg)