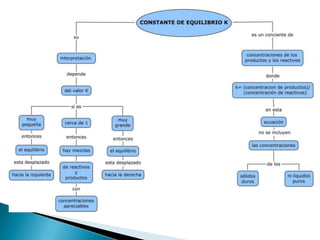
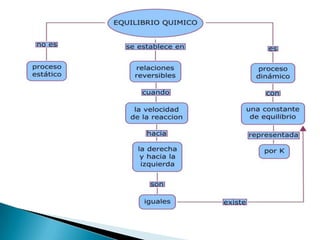
El documento resume los conceptos clave de equilibrio químico, incluyendo que se establece cuando las velocidades de formación y descomposición de productos son iguales, manteniendo constantes las concentraciones. También define la constante de equilibrio como la relación entre las concentraciones de productos e reactantes cuando se alcanza el equilibrio. Finalmente, explica cómo la constante de equilibrio indica la posición del equilibrio.







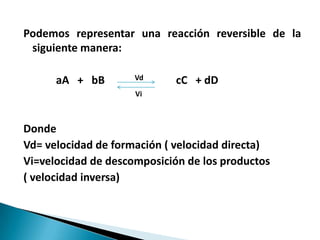
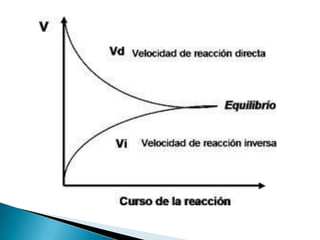



![Para la reacción
aA + bB Vd cC + dD
Vi
La velocidad directa es: Vd = Kd [A]a [B]b
Mientras que para la reacción inversa es:
Vi = Ki [C]c [D]d](https://image.slidesharecdn.com/equilibrioqumico-130425170218-phpapp01/85/Equilibrio-quimico-14-320.jpg)
![ Como las dos velocidades en el equilibrio son iguales
tendríamos que:
Kd [A]a [B]b = Ki [C]c [D]d
Si pasamos las dos constantes al mismo
lado, nos queda:
Kd = [C]c [D]d
Ki = [A]a [B]b](https://image.slidesharecdn.com/equilibrioqumico-130425170218-phpapp01/85/Equilibrio-quimico-15-320.jpg)
![ Como Kd y Ki son constantes se pude decir que:
Kd / Ki = Ke
Y por tanto la ecuación para calcular la constante de
equilibrio es:
[C]c [D]d
Ke =
[A]a [B]b](https://image.slidesharecdn.com/equilibrioqumico-130425170218-phpapp01/85/Equilibrio-quimico-16-320.jpg)