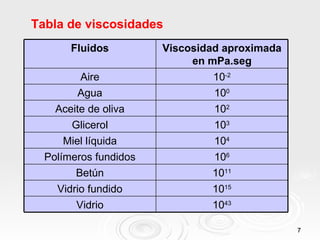
Este documento habla sobre el estado líquido de la materia. Explica que los líquidos tienen volumen definido pero forma variable, y propiedades como tensión superficial, viscosidad, presión de vapor y punto de ebullición, las cuales dependen de las fuerzas intermoleculares y la temperatura. También define estos términos clave y proporciona ejemplos e información sobre cómo cambian estas propiedades con la temperatura.