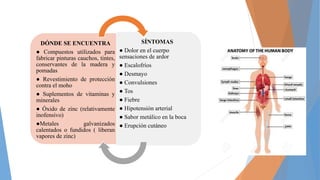
El documento trata sobre las intoxicaciones por zinc, cobalto y aluminio. Describe que el zinc se utiliza en la fabricación de pinturas, tintes y pomadas y que la exposición a sus vapores puede causar fiebre, dolores musculares y erupciones cutáneas. El aluminio se encuentra en utensilios de cocina y su ingestión puede dañar el sistema nervioso central. La exposición a altas dosis de cobalto puede provocar vómitos, problemas de visión y cardiacos.