Este documento presenta información sobre intoxicaciones por cobre, estaño, aluminio, zinc y cobalto. Detalla la historia, usos, efectos para la salud y reacciones de identificación de cada elemento. Incluye detalles sobre las propiedades químicas y físicas de los metales, así como sobre los síntomas agudos y crónicos que pueden causar una intoxicación.






























![5.6 Verter las vísceras en un vaso de precipitación.
5.7 Destilar, recoger el destilado en 4g de clorato de potasio.
5.8 Con aproximadamente 15 mL del destilado recogido (muestra) realizar las
reacciones de reconocimientos en medios biológicos.
6. REACCIONES DE IDENTIFICACIÓN:
6.1 Con el Ferrocianuro de Potasio: En un medio acidificado con ácido
acético, el cobre reacciona dando un precipitado rojo oscuro de ferrocianuro
cúprico, insoluble en ácidos diluidos, soluble en amoniaco dando color azul.
K4Fe(CN)6 + 2Cu(NO3) Cu2Fe(CN)6 + KNO3
6.2 Con el Amoniaco: La solución muestra tratada con amoniaco, forma
primero un precipitado verde claro pulverulento que al agregarle un exceso de
reactivo se disuelve fácilmente dando un hermoso color azul por formación de un
compuesto cupro-amónico.
Cu(NO3)2 + 4NH3 Cu(NH3)4 . (NO3)2
6.3 Con el Cuprón: En solución alcohólica al 1 % al que se le adiciona gotas de
amoniaco, las sales de cobre reaccionan produciendo un precipitado verde
insoluble en agua, amoniaco diluido, alcohol, ácido acético, soluble en ácidos
diluidos y poco solubles en amoniaco concentrado.
C6H5-C=NOH C6H5-C=N-O
C6H5-CHOH + Cu(NO3)2 Cu + 2HNO3
C6H5-C-N-O
6.4 Con el Yoduro de Potasio: Adicionando a la solución muestra gota a gota,
primeramente se forma un precipitado blando que luego se transforma a
pardoverdoso o amarillo.
Cu(NO3)2 + IK + I3
-
6.5 Con los cianuros alcalinos: A una pequeña cantidad de muestra se agregan
unos pocos cristales de cianuro de sodio formando un precipitado verde de
cianuro de cobre, a este precipitado le agregamos exceso de cianuro de sodio y
observamos que se disuelve por formación de un complejo de color verde-café.
(NO3)Cu + 2CNNa (CN)2Cu + NO3
- + Na+
(NO3)Cu + 3CNNa [Cu(CN)3]= + 3Na+
6.6 Con el Hidróxido de Amonio: A la solución muestra, agregarle algunas
gotas de NH4OH, con lo cual en caso positivo se forma un precipitado color
azul claro de solución NO3 (OH) Cu. Este precipitado es soluble en exceso de](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-31-320.jpg)
![reactivo, produciendo solución color azul intenso que corresponde al complejo
[Cu(NH3)4]++.
(NO3)2Cu + NH3 Cu(OH)NO3
(NO3)2Cu +3 NH3 2[Cu(NH3)4+++ NO3H + H2O
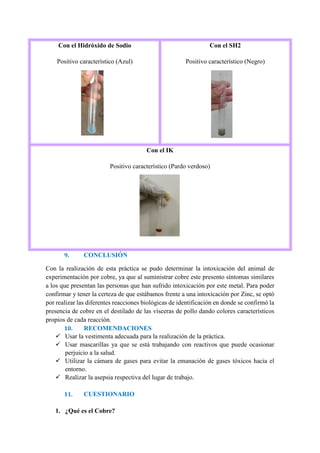
6.7 Con el Hidróxido de Sodio: A 1ml de solución muestra, agregamos algunas
gotas de de NaOH, con lo cual en caso de ser positivo se debe formar un
precipitado color azul pegajoso por formación de Cu(OH)2.Este precipitado es
soluble en ácidos minerales y en álcalis concentrados.
Cu++ + 2OH Cu(OH)2
6.8 Con el SH2: A la solución muestra, hacerle pasar una buena corriente de
SH2, con lo cual en caso de ser positivo se forma un precipitado color negro este
precipitado es insoluble en exceso de reactivo, en KOH 6M, en ácidos minerales
diluidos y fríos .
(NO3)2Cu + SH2 SCu+ 2NO3H
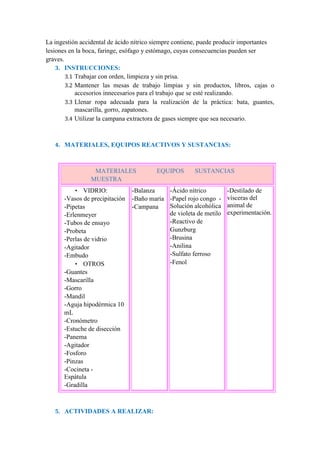
6.9 Con el IK: A una pequeña porción de solución muestra agregarle gota a gota
de solución de IK, con lo cual en caso de ser positivo se forma inicialmente un
precipitado color blanco que luego se transforma en pardo verdoso o por
formaciones de iones tri yoduros, el mismo que se puede volar con Tio sulfato
de sodio.
(NO3)Cu + Tri yoduros](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-32-320.jpg)



































![2
.
Región de Murcia. Riesgos Quimicos-Accidentes Graves: Acido
Nitrico. [Online].; 2007 [cited 2017 Julio 15. Available from:
https://www.murciasalud.es/recursos/ficheros/99959-
Acidonitrico.pdf.
3
.
Acido Nitrico. [Online].; 2003 [cited 2017 Julio 15. Available from:
http://www.uab.cat/doc/DOC_RiscosLab13_DF_Guia_us_Acid_Nit
ric.
4
.
Instituto Nacional de Higiene y Salud en el Trabajo.
DOCUMENTACIÓN TOXICOLÓGICA PARA EL
ESTABLECIMIENTO DEL LÍMITE DE EXPOSICIÓN
PROFESIONAL DEL ÁCIDO NÍTRICO. [Online].; 2007 [cited 2017
Julio 15. Available from:
http://www.insht.es/InshtWeb/Contenidos/Documentacion/Textos
Online/Valores_Limite/Doc_Toxicologica/FicherosSerie2/DLEP%2
022.pdf.
5
.
Fertiberia. Acido Nitrico. [Online].; 2013 [cited 2017 Julio 15.
Available from:
http://www.fertiberia.com/media/217419/fds_acido_nitrico.pdf.
6
.
New Jersey Department of Health. Hoja Informativa sobre
Sustancias Peligrosas. [Online].; 2016 [cited 2017 Julio 15.
Available from:
http://nj.gov/health/eoh/rtkweb/documents/fs/1356sp.pdf.](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-70-320.jpg)













![industrias disminuyan la concentración de estos álcalis en los productos y evitar
más muertes.
BIBLIOGRAFIA
1. Baustita Casanova A, Allegues Martín F. Asociación Española de Pediatria.
[Online].; 2009 [cited 2017 Julio 25. Available from:
https://www.aeped.es/sites/default/files/documentos/causticos.pdf.
2. Muñoz Ribiola J. IDENTIFICACIÓN DE LOS FACTORES DE RIESGOS
TÓXICOS QUE PUEDEN CAUSAR LOS ÁCIDOS Y ÁLCALIS CÁUSTICOS EN
PRODUCTOS DE USO COTIDIANO. [Online].; 2016 [cited 2017 Julio 25.
Available from:
http://repositorio.utmachala.edu.ec/bitstream/48000/7751/1/Mu%C3%B1oz.pdf.
3. Saracco AS. Recomendaciones para la atencion de las intoxicaciones por
cáusticos. [Online].; 2016 [cited 2017 Julio 25. Available from:
http://www.toxicologia.org.ar/wp-
content/uploads/2016/03/recomendaciones.pdf.
4. Mencías E. Intoxicación por Cáusticos. Revista Scielo. 2003; 26(1).
5. Muñoz Bernal JA. Intoxicación por álcalis-cáustico. In Mintegui S. Manual de
Intoxicaciones en Pediatria. Madrid: Ergon S.a; 2003.
6. Hernández Pérez JM, García Viada M. Intoxicaciones por productos domésticos
e industriales. Revista de Urgencias de Atención Primaria. 2003 Enero;
59(1459).
7. Almarza E, Martínez MA, Sánchez de la Torre C. Análisis químicos realizados
en casos de intoxicaciones por detergentes y limpiadores. Revista de
Toxicología. 2002; 19.
8. Ramírez JM. Control y tratamiento médico por ingestión de sustancias
cáusticas. Revista MEDISAN. 2010 Abril; 14(3).](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-85-320.jpg)


![17.2 Mantener las mesas de trabajo limpias y sin productos, libros, cajas o
accesorios innecesarios para el trabajo que se esté realizando.
17.3 Llenar ropa adecuada para la realización de la práctica: bata, guantes,
mascarilla, gorro, zapatones.
17.4 Utilizar la campana extractora de gases siempre que sea necesario.
18. MATERIALES, EQUIPOS REACTIVOS Y SUSTANCIA
19. ACTIVIDADES A REALIZAR:
19.1 Limpiar el mesón de trabajo y tener a mano todos los materiales a utilizarse
19.2 Preparar la conexión de electricidad
19.3 Colocar un volumen adecuado de agua en el recipiente con sal
19.4 Añadir un pedazo de yuca en el recipiente con sal
19.5 Con el cable debemos tocar el tubérculo y se enciende el foco
19.6 El estudiante debe tocar el agua que está en el recipiente
20. REACCIONES DE IDENTIFICACIÓN:
Titulación de cianuros con AgNO3 : método de Liebig.
Cuando se adiciona solución de AgNO3 sobre una solución de un cianuro se forma un
complejo altamente estable e incoloro:
Ag+
+ 2 CN-
Ag(CN)2
-
K2 = [Ag(CN)2-
] / [Ag+
][CN-
]2
= 1.26 x 1021
(1)
Una vez que la anterior reacción se ha completado, el primer exceso de Ag+ produce
precipitación de cianuro de plata:
Ag+
+ Ag(CN)2-
2 AgCN (s) (2)
La aparición de un precipitado blanco de cianuro de plata es usado como pf en la titulación
de Liebig. El equilibrio entre el precipitado de cianuro de plata y sus iones en solución es
caracterizado por su Kps :
MATERIALES EQUIPOS SUSTANCIAS MUESTRAS
Vasos de
precipitación
Agitador
Gorro
Mandil
Llave
Cable de
electricidad
Foco
Interruptor
Recipiente de
vidrio
Aparato de
carga iónica
Sulfato de cobre
Sal
Yuca](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-88-320.jpg)
![AgCN (s) Ag+
+ CN-
Kps = [Ag+
][CN-
] = 4.2 x 10-17
(3)
Combinando esta ecuación con la de complejación se obtiene la constante de equilibrio
para la reacción (2), responsable del pf:
2 AgCN (s) Ag+
+ Ag(CN)2-
Kps' = [Ag+
][Ag(CN)2
-
] = K2 Kps2
= 2.2 x 10-
12
21. GRÁFICOS:
22. RESULTADOS OBTENIDO](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-89-320.jpg)






![1. OMS. Inocuidad de los alimentos. [Online].; 2015 [cited 2017 Agosto
18. Available from:
http://www.who.int/mediacentre/factsheets/fs399/es/.
2. Herbolari i Dietética LA NAU. Glucósidos Cianogénicos. [Online].
[cited 2017 Agosto 18. Available from:
http://www.herbolarilaneu.com/es/farmacognosia/48-metabolitos-
secundarios/glucosidos-o-glicosidos/glucosidos-cianogenicos.
3. Valle Vega P, Florentino BL. Toxicologia de los Alimentos. [Online].
México; 2000 [cited 2017 Agosto 16. Available from:
http://www.bvsde.paho.org/eswww/fulltext/toxicolo/toxico/toxico.pdf.
4. Montaldo A. Yuca o Mandioca. Segunda ed. de la Cruz M, editor.
Costa Rica: IICA; 1985.](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-96-320.jpg)








![ Evitar el contacto de plantas tóxicas por falta de conocimiento de las
propiedades que contienen.
Bibliografía
1. Peacok B, Suárez M, Berenguer C, Pérez L. Intoxicaciones por
plantas tóxicas atendidas desde un servicio de información
toxicológica. Revista Cubana de Plantas Medicinales. 2009
Marzo; 2(1-7).
2. REDVET. Evaluación de la toxicidad aguda de extractos de
plantas medicinales por un método alternativo. Revista
electrónica de Veterinaria. 2007 Marzo; VII(1-5).
3. Leiva L, Escobar R, Morales J, Sorí Y, Escobar G. Intoxicaciones
agudas por plantas tóxicas reportadas. Scielo. 2017; 1(401).
4. García y Santos C, Capelli A. Intoxicaciones por plantas y
micotoxinas en rumiantes diagnosticadas en Uruguay. Scielo.
2016 Mayo; 52(202).
5. Pinillos , Gómez J, Elizalde J, Dueñas A. Intoxicación por
alimentos, plantas y setas. Scielo. 2003; 26(243-263).
6. En Colombia. [Online]. [cited 2017 Julio 10. Available from:
https://encolombia.com/medicina/guiasmea/u-
toxicologicas/intoxicacionespor-plantas/.
7. Nogué S, Simón J, Blanché C, Piqueras J. Fetoc. [Online].; 2009
[cited 2017 Julio 10. Available from:
http://www.fetoc.es/asistencia/intoxicaciones_plantas_y_setas_c
ompleto_2009.pdf.
8. Ramírez M, Mujica Y, Pascuzzu L, Ramírez M. PROBABLE
INTOXICACIÓN PORACHICORIA(CICHORIUM INTYBUS).
ARCHIVOS VENEZOLANOS DE PUERICULTURA Y
PEDIATRÍA. 2007; 2(69-72).](https://image.slidesharecdn.com/portafolio2-170826155430/85/Portafolio-2-105-320.jpg)