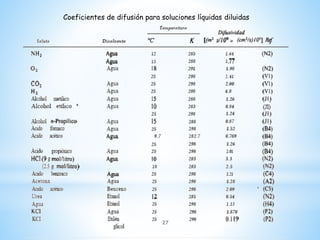
Este documento describe varios métodos experimentales para medir la difusión molecular en gases y líquidos. Explica que la difusión en líquidos es más lenta que en gases debido a la mayor proximidad de las moléculas. También presenta ecuaciones teóricas y semiempíricas para predecir coeficientes de difusión en diferentes condiciones, así como valores experimentales típicos.








![La ecuación de Lennard-Jones es bastante
complicada y con mucha frecuencia no se
dispone de algunas de las constantes como sAB, y
tampoco es facil estimarlas. Debido a esto, se
usa con más frecuencia el método semiempírico
de Fuller y colaboradores.
1 x 10-7 T1.75 (1/MA + 1/MB)1/2
DAB =
P [(SnA
2)1/3 + (SnB)1/3]2
10](https://image.slidesharecdn.com/coeficientesdedifusiondegases-140611134924-phpapp02/85/Coeficientes-de-difusion-de-gases-10-320.jpg)







![1. La expresión general para contradifusión
equimolar, para líquidos en estado
estacionario donde NA = -NB.
DAB (cA1 – cA2) DAB cprom(xA1 – xA2)
NA = =
(z2 – z1) (z2 – z1)
cprom = (r / M)prom = [(r1/M1) / (r2/M2)]/2
19](https://image.slidesharecdn.com/coeficientesdedifusiondegases-140611134924-phpapp02/85/Coeficientes-de-difusion-de-gases-19-320.jpg)