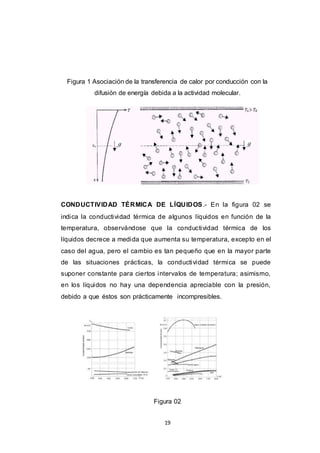
Este documento presenta varios conceptos relacionados con balances de materia y transferencia de materia. Explica el balance de materia aplicado a una envoltura y las condiciones límite asociadas. También describe diferentes tipos de difusión como la difusión a través de una película gaseosa, la difusión con reacción química heterogénea y homogénea, y la transferencia de materia por convección forzada. Finalmente, presenta expresiones semiempíricas para la densidad de flujo turbulento de materia, incluyendo la