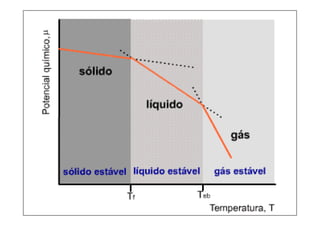
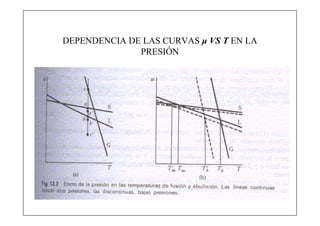
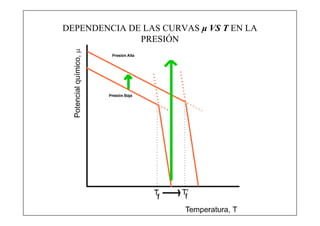
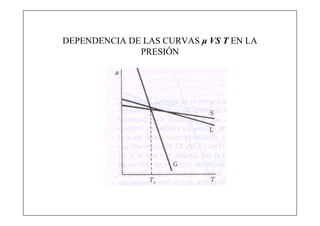
Este documento explica la condición de equilibrio para un sistema en equilibrio sólido-líquido. Indica que para el equilibrio, los potenciales químicos de las fases deben ser iguales. También discute cómo los potenciales químicos de las fases dependen de la temperatura y la presión.