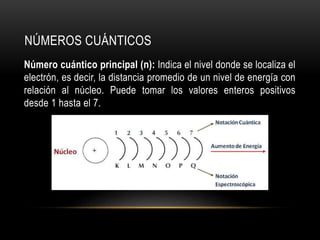
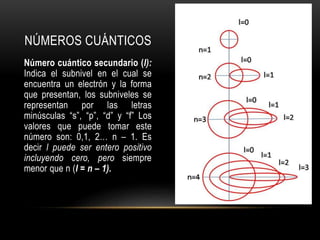
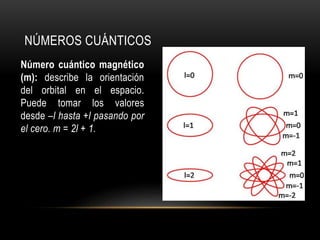
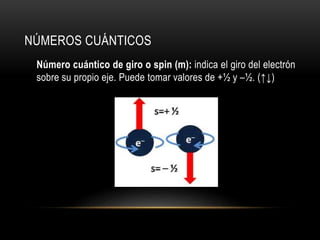
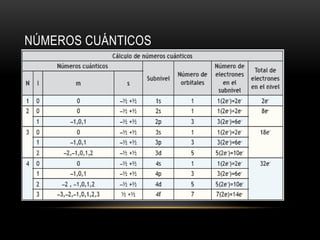
Este documento resume los números cuánticos y la configuración electrónica. Explica que los números cuánticos (n, l, m, s) describen el estado de un electrón al determinar en qué nivel, subnivel, orbital y giro se encuentra. Luego describe cada número cuántico y cómo representa la configuración electrónica la estructura de los electrones en los átomos según los principios de exclusión de Pauli, edificación progresiva y la regla de Hund.