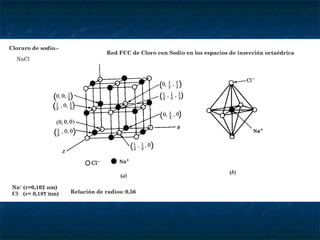
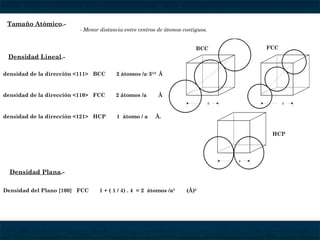
El documento describe las estructuras cristalinas, incluyendo las redes de Bravais, los 7 sistemas cristalinos, la disposición de átomos en sistemas FCC, BCC y HCP, y cómo calcular el volumen de la celda elemental, densidad, factor de empaquetamiento y tipos de intersticios para diferentes estructuras cristalinas como CsCl, NaCl y CaF2. También explica conceptos como tamaño atómico, relación de radios iónicos y la ubicación de cationes y aniones en estas estructuras.








![Factor de Empaquetamiento .- BCC : FEA = [2 átomos / c.u. 4/3 r 3 (Å 3 /at.) / a 3 (Å 3 / c.u.) FEA = 0.68. (BCC) r = (3 1/2 / 4) a Un 68% del volumen de esta celda está ocupado; el 32% estará vacío FCC : FEA = [4 átomos / c.u.] 4/3 r 3 (Å 3 /at.) / a 3 (Å 3 / c.u.) (FCC) r = (2 1/2 / 4) a FEA = 0.74 Un 74% del volumen de esta celda está ocupado; el 26% estará vacío } } HCP : FEA = 0.74](https://image.slidesharecdn.com/cristalinosmetales-111006114336-phpapp02/85/cristales-metalicos-11-320.jpg)