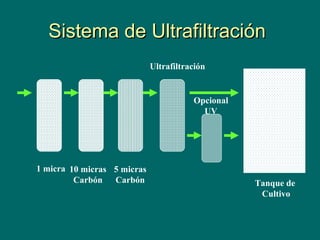
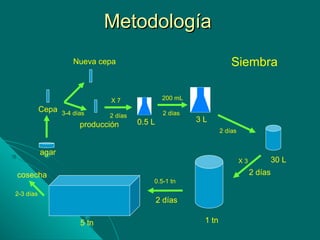
Este documento describe los criterios y métodos para el cultivo de microalgas. Explica las clases principales de microalgas, sus requerimientos nutricionales y de cultivo, y los tipos de sistemas de cultivo como por lotes, semicontinuos y continuos. Además, detalla los procedimientos para tratar el agua de cultivo, como filtración, esterilización y clorinación, para mantener las condiciones óptimas para el crecimiento de las microalgas.