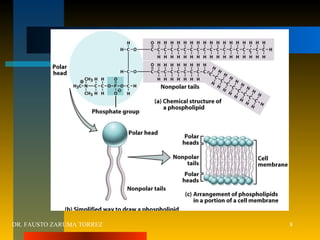
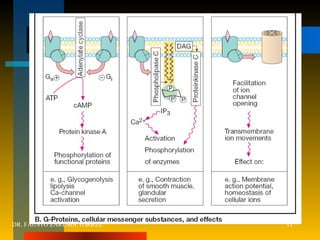
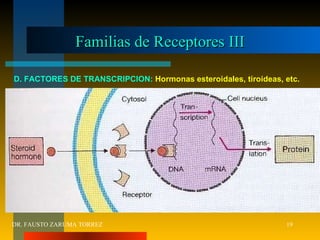
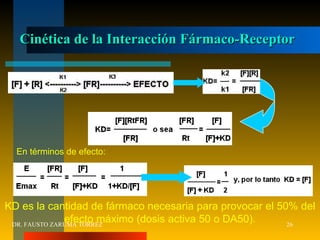
El documento resume los principios fundamentales de la farmacodinamia. Explica que los fármacos actúan al unirse a receptores específicos en las células, y que esta unión causa efectos a nivel celular y del organismo. También describe la evolución histórica del concepto de receptor, los tipos de receptores, y cómo la interacción fármaco-receptor determina la eficacia y potencia de los fármacos. Finalmente, analiza conceptos como la regulación de receptores, las interacciones entre fármacos,