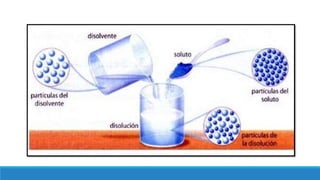
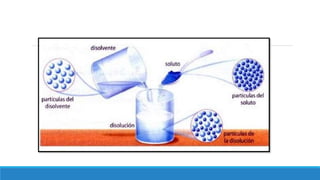
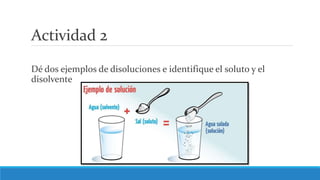
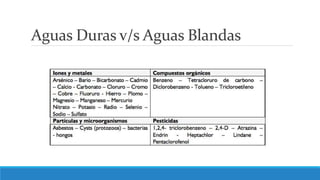
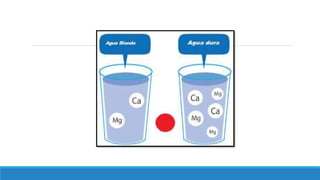
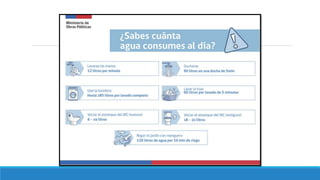
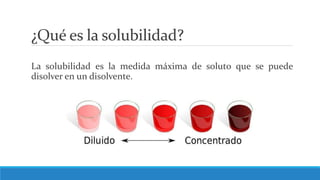
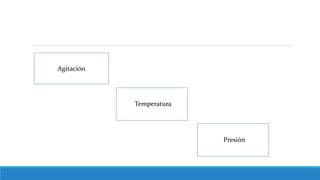
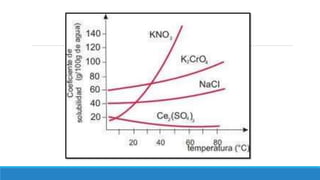
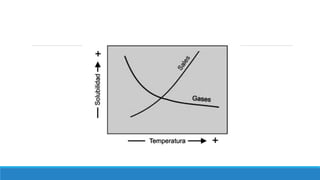
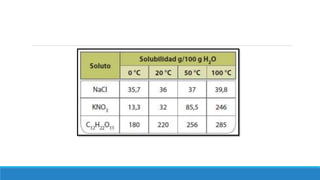
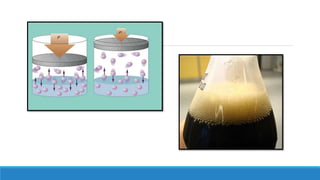
El documento proporciona una introducción a las disoluciones, explicando que son mezclas homogéneas de dos o más sustancias. Define los componentes clave de una disolución, incluido el disolvente, el soluto y la disolución misma. Explica conceptos como solubilidad, factores que afectan la solubilidad como la agitación, temperatura y presión. También cubre temas como aguas duras vs. aguas blandas y solubilidad.