Sistemas Materiales: Materia, Sustancias, Soluciones y Dispersiones
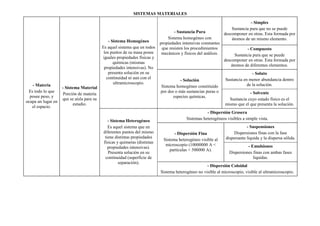
- 1. SISTEMAS MATERIALES - Materia Es todo lo que posee peso, y ocupa un lugar en el espacio. - Sistema Homogéneo Es aquel sistema que en todos los puntos de su masa posee iguales propiedades físicas y químicas (mismas propiedades intensivas). No presenta solución en su continuidad ni aun con el ultramicroscopio. - Sistema Material Porción de materia que se aísla para su estudio. - Sistema Heterogéneo Es aquel sistema que en diferentes puntos del mismo tiene distintas propiedades físicas y quimeras (distintas propiedades intensivas). Presenta solución en su continuidad (superficie de separación). - Sustancia Pura Sistema homogéneo con propiedades intensivas constantes que resisten los procedimientos mecánicos y físicos del análisis. - Solución Sistema homogéneo constituido por dos o más sustancias puras o especies químicas. - Simples Sustancia pura que no se puede descomponer en otras. Esta formada por átomos de un mismo elemento. - Compuesto Sustancia pura que se puede descomponer en otras. Esta formada por átomos de diferentes elementos. - Soluto Sustancia en menor abundancia dentro de la solución. - Solvente Sustancia cuyo estado físico es el mismo que el que presenta la solución. - Dispersión Grosera Sistemas heterogéneos visibles a simple vista. - Dispersión Fina Sistema heterogéneo visible al microscopio (10000000 A < partículas < 500000 A). - Suspensiones Dispersiones finas con la fase dispersante liquida y la dispersa sólida. - Emulsiones Dispersiones finas con ambas fases liquidas. - Dispersión Coloidal Sistema heterogéneo no visible al microscopio, visible al ultramicroscopio.
- 2. La materia presenta dos tipos de propiedades: a) Propiedades extensivas y b) Propiedades intensivas. a) Las propiedades extensivas: dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. b) Las propiedades intensivas, en cambio, tienen que ver más con la estructura química interna de la materia, como la temperatura, punto de fusión, punto de ebullición, calor específico, concentración, índice de refracción, entre otros aspectos. Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que está compuesta por un solo tipo de molécula, como, por ejemplo, el agua, que está formada solo por moléculas de agua (H2O), o el azúcar, que solo la conforman moléculas de sacarosa (C12H22O11). TIPOS DE SOLUCIONES SOLUTO Gas SOLVENTE Gas SOLUCION Gas EJEMPLO Aire (O2, N2) Gas Liquido Liquido Bebidas carbonatadas (CO2 en H2) Liquido Liquido Liquido Vino (etanol en H2O) Vinagre (ácido acético en H2O) Líquido Sólido Sólido Amalgamas (Hg en Ag) Sólido Líquido Líquido NaCl, azucar en H2O Sólido Sólido Sólido Oro 14 kilates (Ag en Au), Oro blanco (Au con elementos del grupo de los platinoide (platino, paladio, rodio, osmio e iridio, lo mas común es usar paladio) Acero carbono en Fe; Alpaca (Zn, Cu, Ni) (aleaciones)