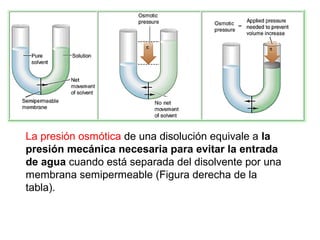
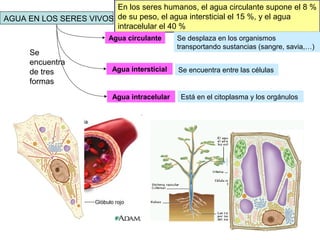
El documento describe las biomoléculas inorgánicas presentes en los seres vivos. Explica que el agua y las sales minerales son moléculas inorgánicas fundamentales que cumplen funciones estructurales y metabólicas. El agua constituye el 70% de la masa de los seres humanos y participa en reacciones químicas y transporte de sustancias. Las sales minerales como cloruros, fosfatos y carbonatos regulan procesos celulares y mantienen el pH corporal a través de sistemas amort
















![En el agua una pequeña cantidad de moléculas se encuentran
ionizadas según la siguiente ecuación:
H2O + H2O H3O+
+ OH-
+ -
En 1 mol de agua hay 10-7
moles de moléculas ionizadas. El pH se
define como el logaritmo con signo negativo de la concentración de
iones H3O+
. pH= -log [H3O+
]
El pH del agua será por lo tanto de 7
pH= -log [10-7
]= 7
++](https://image.slidesharecdn.com/elagua-110920143249-phpapp02/85/El-agua-18-320.jpg)

![•Neutro cuando [H+
]=[OH-
]
•Ácido cuando [H+
]>[OH-
]
•Alcalino cuando [H+
]<[OH-
].
Acido Base
H+ OH-
7
6 8](https://image.slidesharecdn.com/elagua-110920143249-phpapp02/85/El-agua-20-320.jpg)