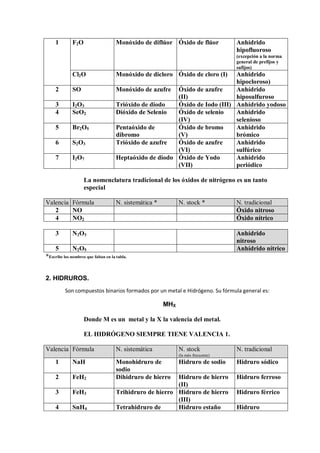
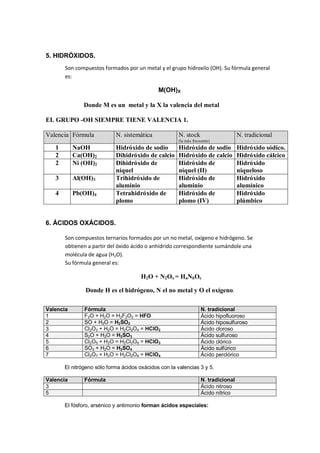
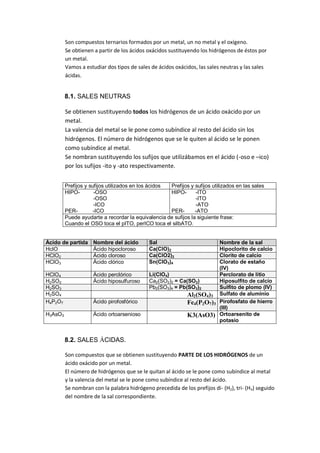
Este documento presenta información sobre la caracterización de funciones químicas inorgánicas. Explica los objetivos del laboratorio, que son estudiar las propiedades de los elementos y preparar funciones químicas para identificar sus características. Luego describe varios tipos de compuestos inorgánicos como óxidos, hidruros, ácidos hidrácidos y hidróxidos, y proporciona tablas con sus fórmulas, nomenclaturas sistemática, IUPAC y tradicional.