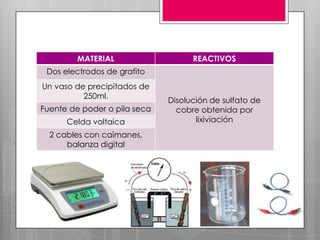
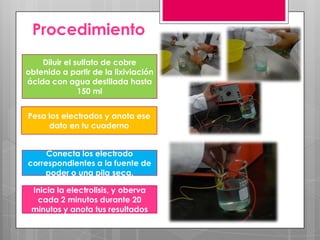
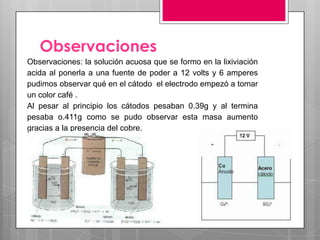
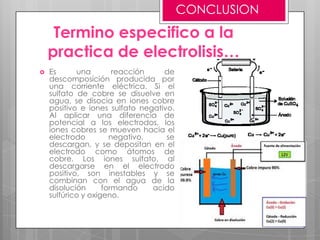
La electrólisis es un proceso para separar un compuesto en sus elementos utilizando electricidad. Involucra disolver o fundir un electrólito y aplicar una corriente eléctrica continua a través de electrodos, atrayendo los iones opuestamente cargados a cada electrodo donde se depositan como nuevas sustancias. Este método puede usarse para obtener metales puros a partir de sus sales.