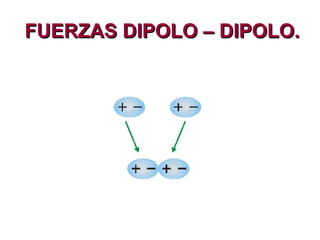
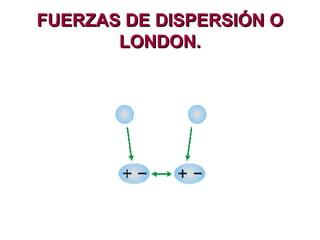
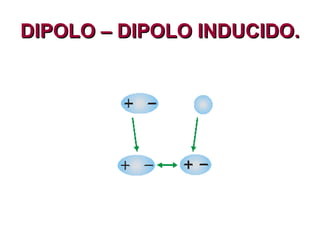
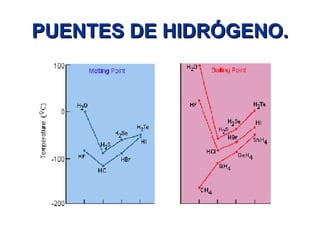
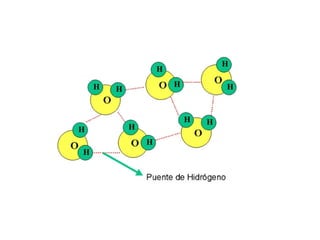
Este documento describe las fuerzas intermoleculares y intramoleculares. Las fuerzas intermoleculares, como el enlace de hidrógeno y las fuerzas de Van der Waals, mantienen unidas las moléculas en los estados sólido y líquido. Son débiles pero permiten la disolución. Las fuerzas de Van der Waals son debidas a dipolos instantáneos y aumentan con el tamaño molecular. El enlace de hidrógeno es la fuerza intermolecular más fuerte y se da entre átomos de hidrógeno y á