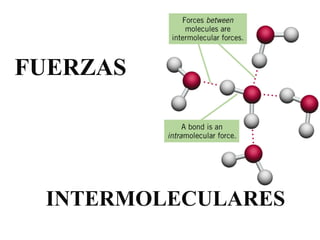
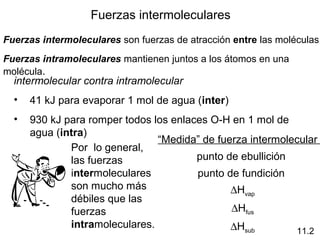
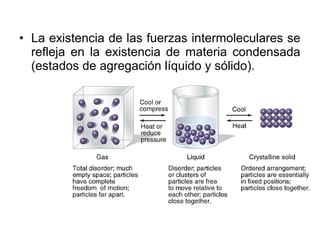
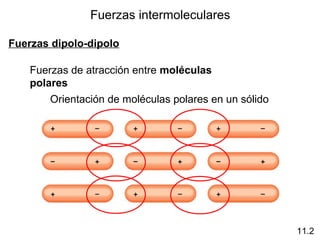
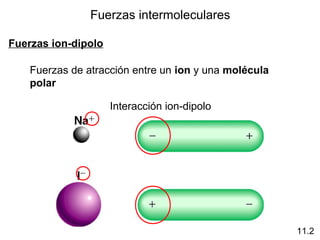
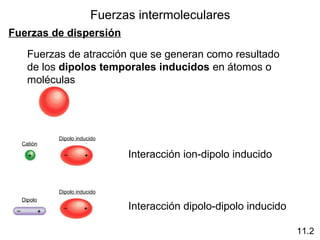
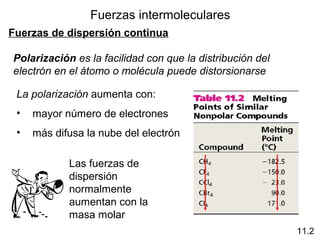
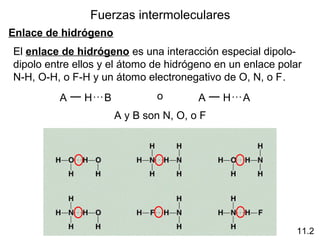
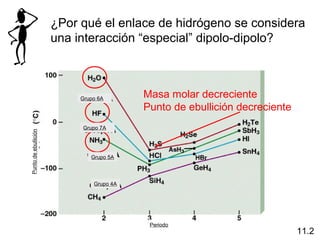
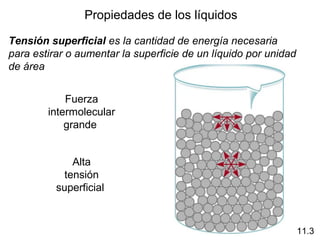
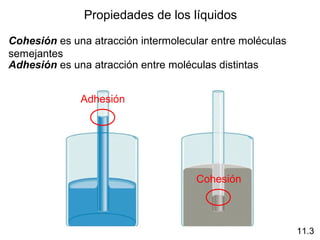
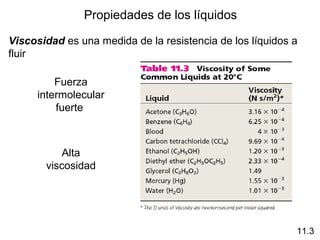
Este documento describe las diferentes fuerzas intermoleculares que existen entre moléculas, incluyendo fuerzas de dispersión, dipolo-dipolo, ion-dipolo, y enlaces de hidrógeno. Explica cómo estas fuerzas débiles entre moléculas dan como resultado los estados condensados de materia como líquidos y sólidos, y cómo propiedades como los puntos de ebullición y fusión reflejan la intensidad de las fuerzas intermoleculares.