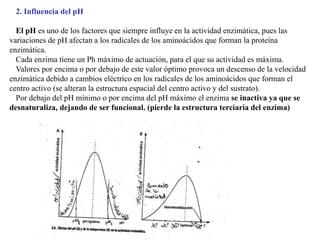
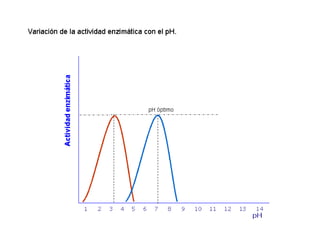
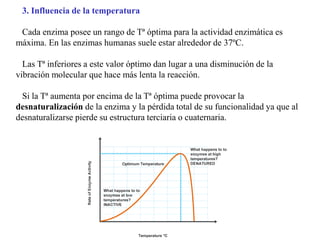
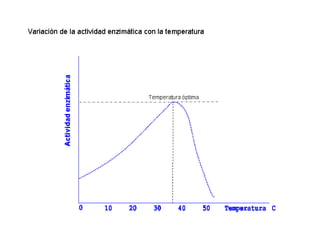
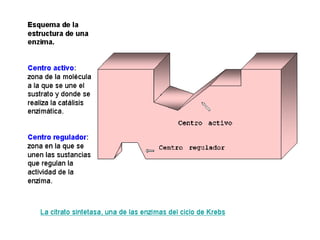
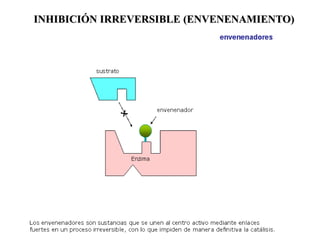
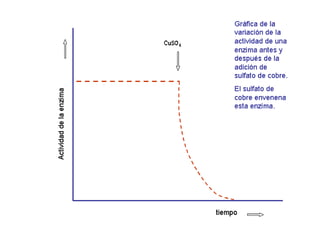
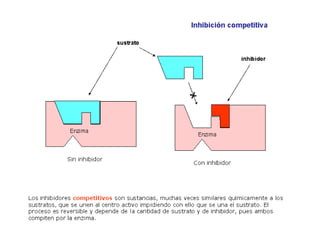
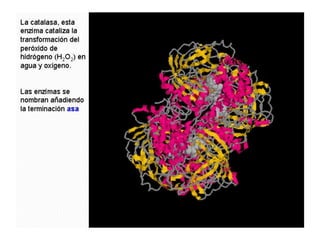
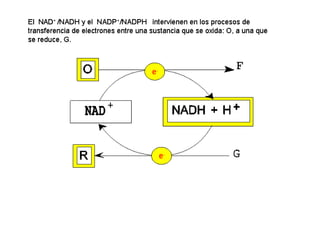
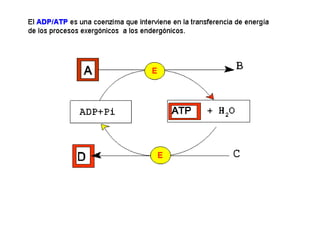
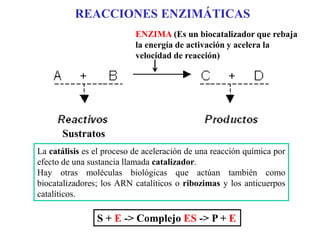
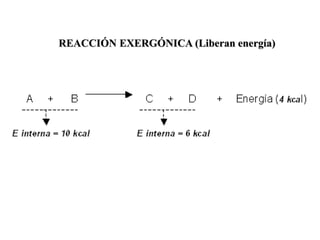
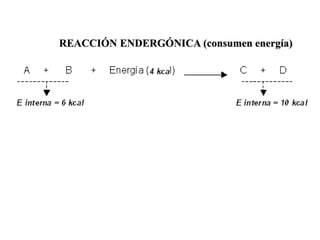
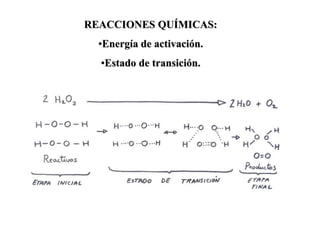
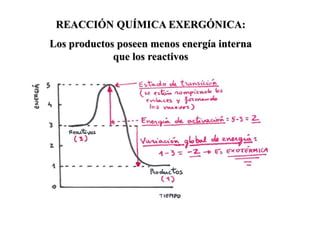
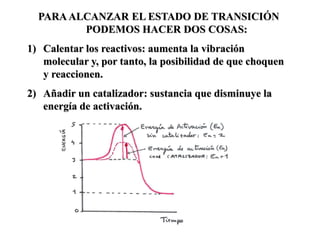
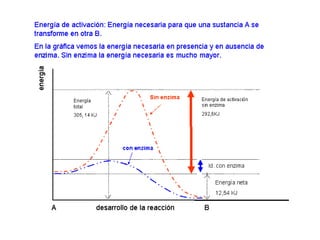
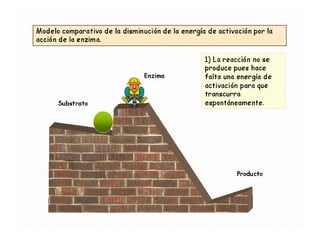
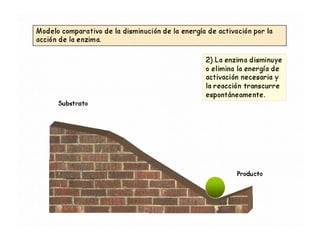
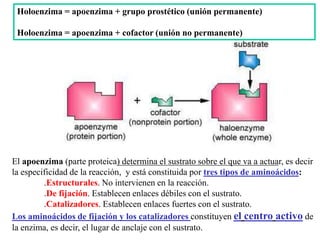
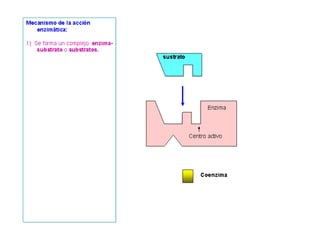
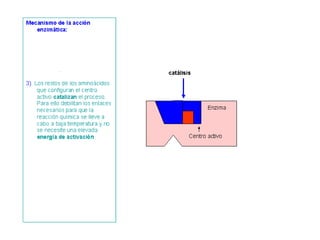
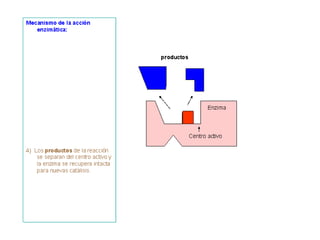
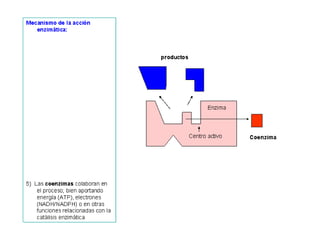
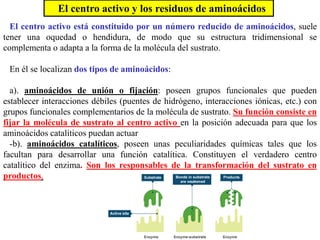
Las enzimas son proteínas que actúan como catalizadores biológicos, acelerando las reacciones químicas en los seres vivos al disminuir la energía de activación requerida. Permiten que las reacciones metabólicas esenciales para la vida ocurran de forma rápida y precisa a temperaturas corporales, ya que cada enzima es específica para una reacción en particular.
























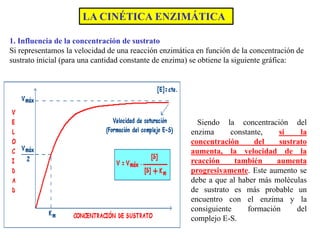

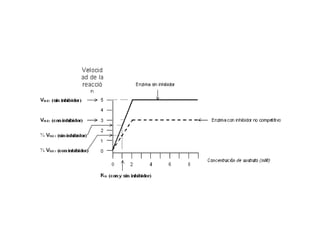
![Para calcular la variación de la velocidad de una reacción enzimática (en función de la concentración
del sustrato) se utiliza la ecuación de Michaelis – Menten (1913).
Donde:
v es la velocidad de la reacción para una determinada concentración de sustrato [S].
Vmax es la velocidad máxima de la reacción
Km es una constante denominada constante de Michaelis-Menten, característica de
cada enzima.
Cuando V =½ Vmax y despejamos Km obtenemos lo siguiente:
Por tanto, Km, que representa la concentración de sustrato (moles/litro) cuando la velocidad
de la reacción es la mitad de la velocidad máxima.
• Si el valor de Km es pequeño, se necesita menor cantidad de sustrato para alcanzar la mitad de la
velocidad máxima, ello nos indica que el enzima tiene gran afinidad por el sustrato.
• Si el valor de Km es alto, se necesita una elevada concentración de sustrato para alcanzar la mitad
de la velocidad máxima, indicando que el enzima tiene poca afinidad por el sustrato.
Por lo tanto, la Km o constante de Michaelis refleja la afinidad de un enzima por su sustrato., La K
es característica de cada enzima](https://image.slidesharecdn.com/enzimasyvitaminas-220922153141-761ad0b4/85/ENZIMAS-Y-VITAMINAS-ppt-43-320.jpg)