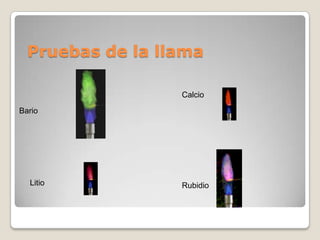
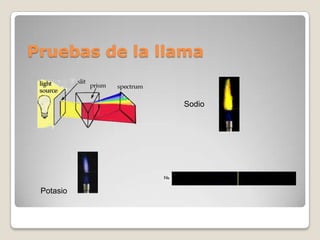
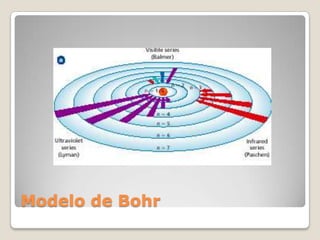
El documento describe el espectro de emisión atómica, que es el conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de un elemento. Cada elemento tiene un espectro de emisión único que puede usarse para identificar si ese elemento es parte de un compuesto desconocido. También explica que el modelo atómico cuántico propuesto por Niels Bohr pudo explicar por qué los espectros son discontinuos y predijo las frecuencias del espectro de hidrógeno, aunque no otros espectros atómicos