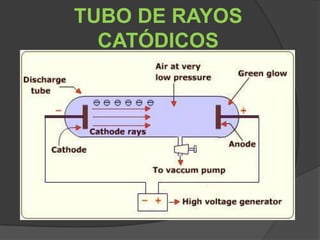
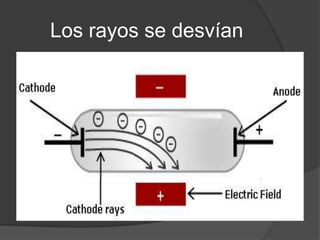
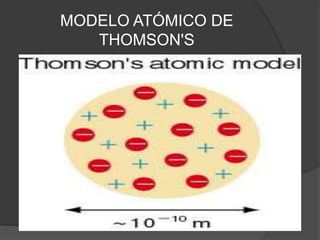
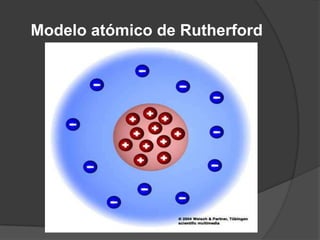
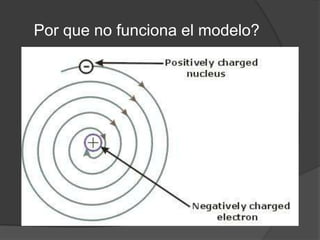
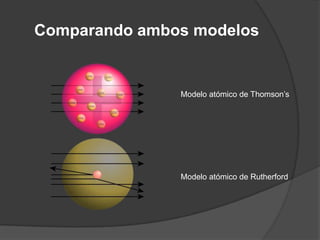
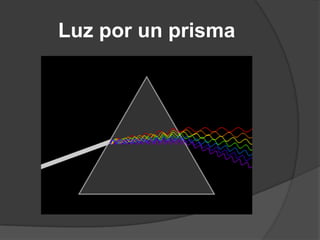
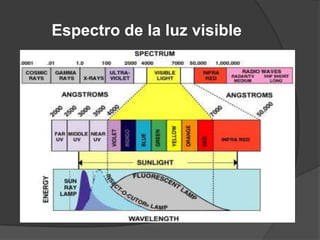
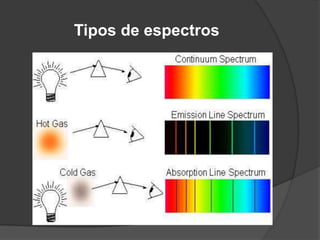
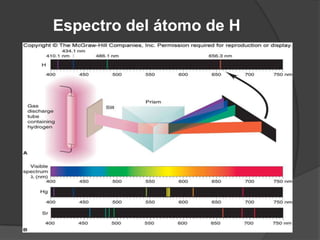
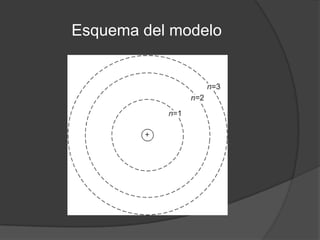
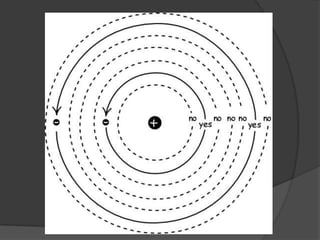
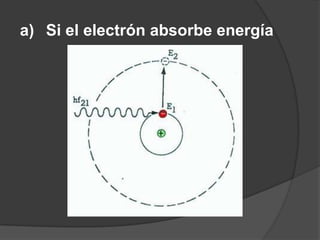
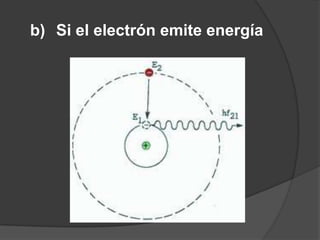
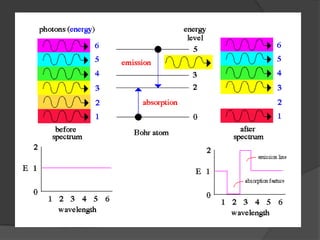
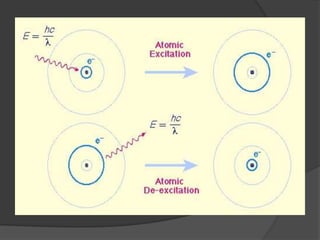
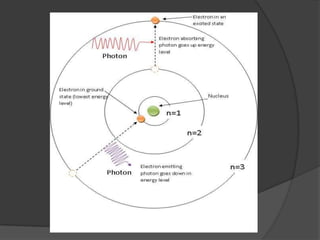
La teoría atómica de Dalton establece que toda la materia está formada por átomos indivisibles e invisibles. Los experimentos de Thomson y Rutherford con tubos de rayos catódicos llevaron al descubrimiento de las partículas subatómicas y al modelo atómico de Rutherford, donde los átomos tienen un núcleo denso rodeado por electrones. Posteriormente, los experimentos de Planck y Bohr permitieron explicar las líneas espectrales discretas y proponer el modelo atómico de Bohr, donde los