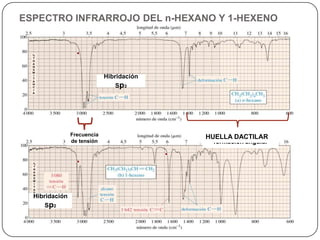
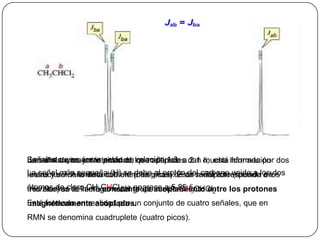
Este documento presenta información sobre diferentes técnicas espectroscópicas como la espectroscopía UV-Visible, espectroscopía infrarroja, resonancia magnética nuclear y espectrometría de masas. Explica brevemente cada técnica y cómo proporciona información sobre la estructura molecular.