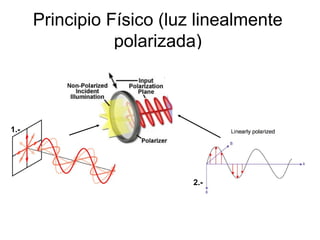
Este documento describe dos técnicas espectroscópicas, la espectroscopía de absorción UV-visible y la espectroscopía de fluorescencia. La espectroscopía de absorción UV-visible mide la absorción de radiación electromagnética por moléculas y puede usarse para identificar compuestos químicos. La espectroscopía de fluorescencia involucra la emisión de luz visible por moléculas excitadas con luz UV y puede usarse para cuantificar compuestos y determinar estructuras proteicas