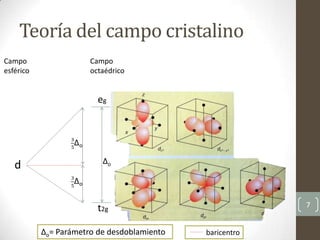
Este documento describe los conceptos fundamentales de la espectroscopía UV-Vis, incluyendo la descripción de los orbitales atómicos y moleculares, las reglas de selección para las transiciones electrónicas, y cómo se utilizan los diagramas de Tanabe-Sugano para analizar los espectros de complejos de coordinación.