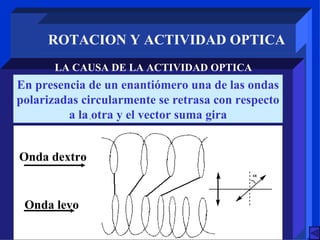
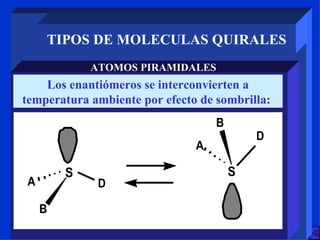
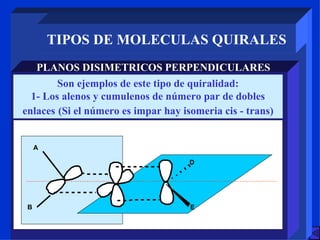
Este documento describe diferentes tipos de estereoisomería, incluyendo estereoisómeros configuracionales y geométricos. Explica que los estereoisómeros configuracionales pueden ser quirales o no quirales, y que los enantiómeros son estereoisómeros quirales no superponibles. También describe la isomería cis-trans, E-Z y diferentes tipos de moléculas quirales como aquellas con átomos tetraédricos o complejos octaédricos.