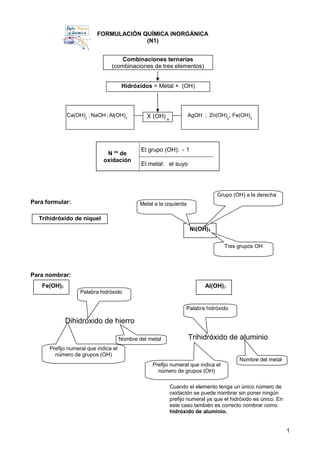
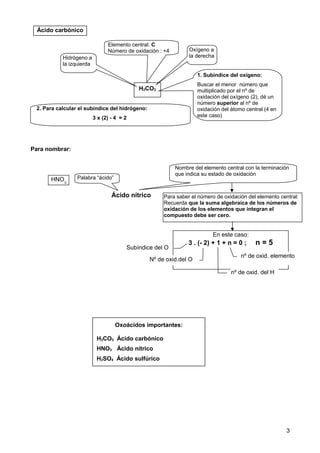
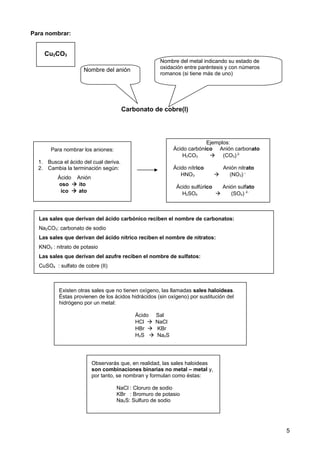
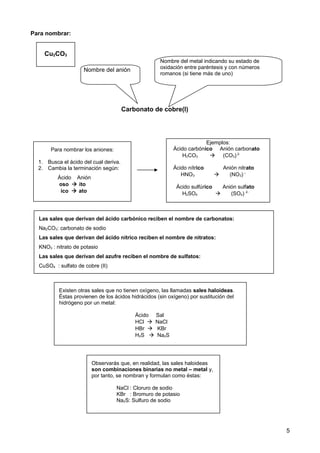
Este documento explica cómo nombrar y formular compuestos inorgánicos como hidróxidos, oxoácidos y sales. Para los hidróxidos, se escribe el nombre del metal seguido de "hidróxido" y un prefijo numeral que indica el número de grupos OH. Los oxoácidos se componen de hidrógeno, un no metal y oxígeno, y la terminación del no metal indica su número de oxidación. Las sales derivan de los ácidos sustituyendo los hidrógenos por metales; el anión indica el ácido