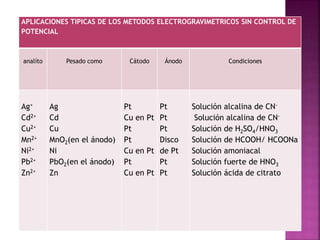
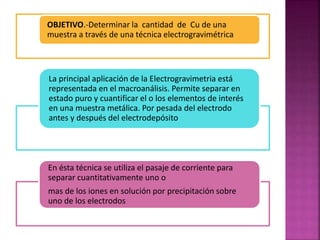
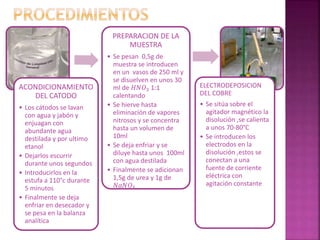
El documento describe el método de electrogravimetría para separar y cuantificar iones en una sustancia mediante electrolisis. La electrogravimetría consiste en electrolizar una muestra y depositar los iones cuantitativamente en los electrodos. El metal depositado en el cátodo se pesa antes y después para calcular la cantidad original en la muestra. La técnica se puede usar con o sin control de potencial y permite determinar varios metales como cobre, plata y zinc.