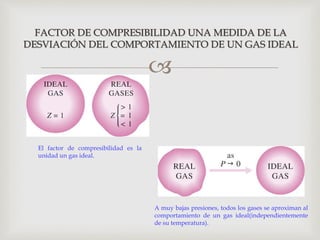
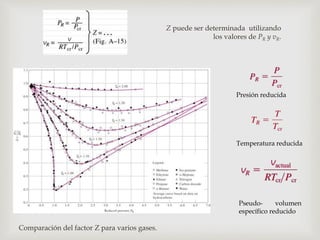
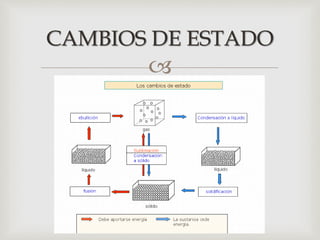
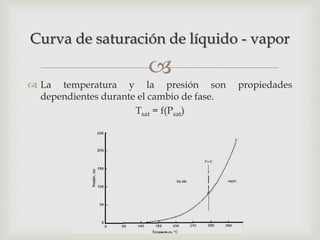
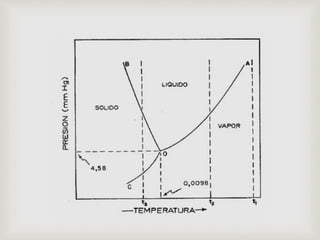
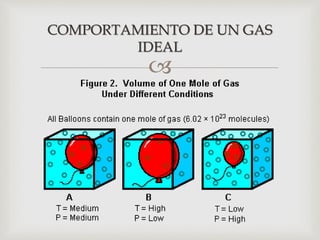
Este documento trata sobre los conceptos fundamentales de los cambios de estado y el comportamiento de las sustancias puras. Explica que una sustancia pura puede existir en diferentes fases (sólido, líquido y gaseoso) y que la temperatura y presión de saturación determinan a qué temperatura ocurre un cambio de fase. También describe las leyes de los gases ideales y cómo los gases reales se desvían de este comportamiento ideal, requiriendo ecuaciones de estado más complejas.


































![
¿Es el vapor de agua un gas ideal?
A presiones por debajo de 10 kPa, el
vapor de agua puede tratarse como un
gas ideal, independientemente de su
temperatura, con error insignificante
(menos del 0.1 por ciento).
A altas presiones, sin embargo, la
hipótesis de gas ideal presenta errores
inaceptables, sobre todo en las
proximidades del punto crítico y la
línea de vapor saturado. En
aplicaciones de aire acondicionado, el
vapor de agua en el aire puede ser
tratado como un gas ideal. ¿Por qué?
En aplicaciones en planta de energía
usando vapor, sin embargo, las
presiones involucradas son muy altas,
por lo tanto, las relaciones de gas ideal
no se deben utilizar.
Porcentaje de error ([|vtabla - videal|/vtabla] 100) involucrados en
el supuesto de que el vapor es un gas ideal, y la región en la que
el vapor puede ser tratada como un gas ideal con menos de 1 por
ciento de error.](https://image.slidesharecdn.com/gases-120414095234-phpapp01/85/Gases-40-320.jpg)