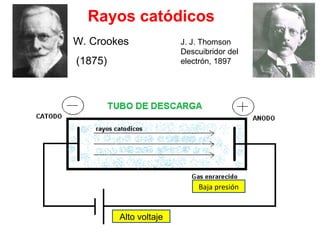
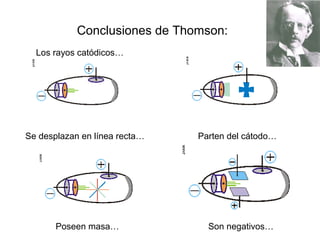
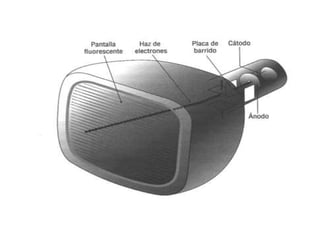
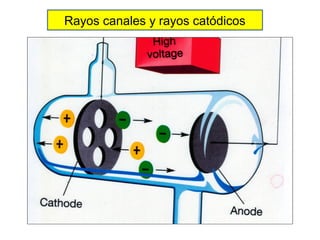
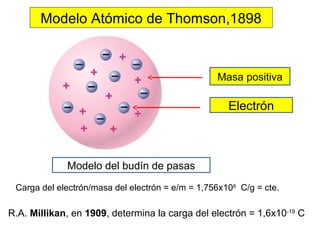
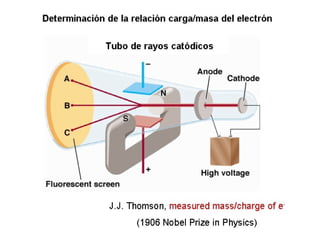
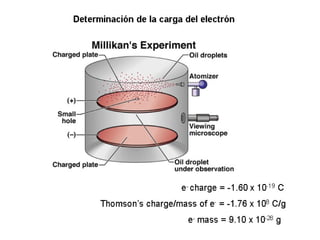
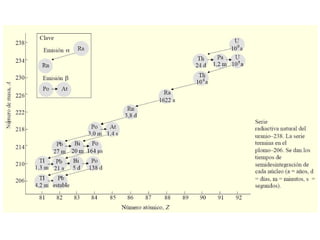
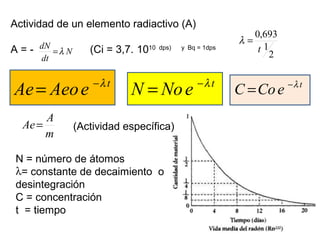
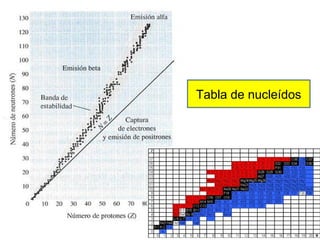
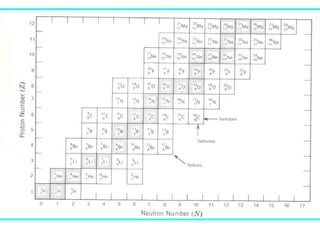
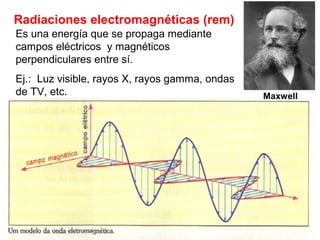
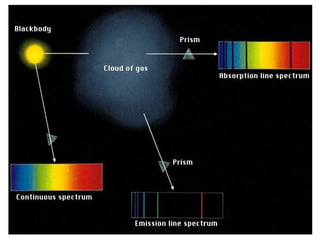
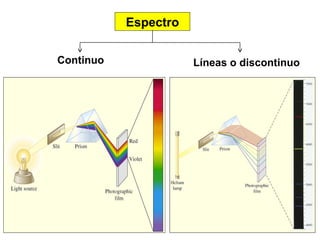
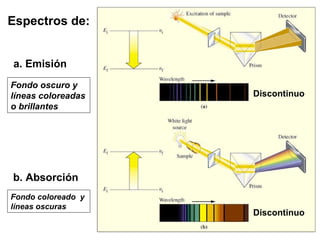
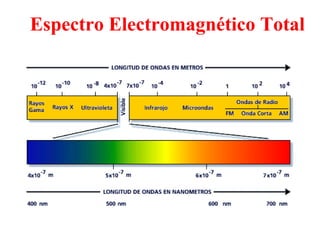
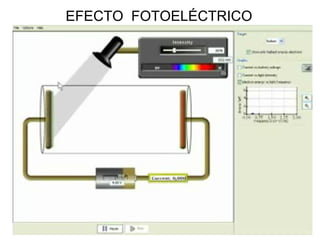
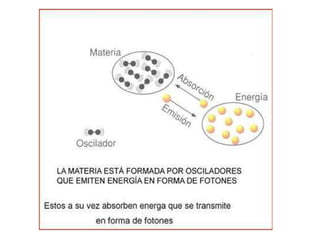
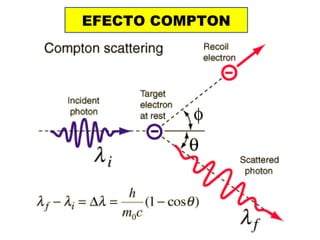
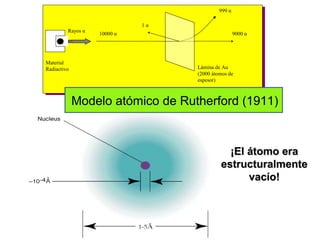
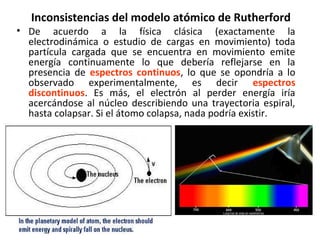
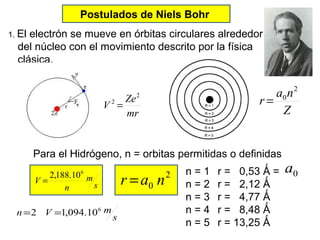
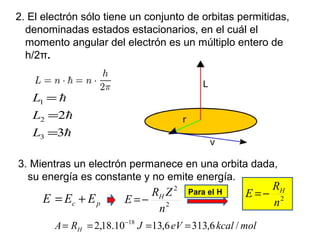
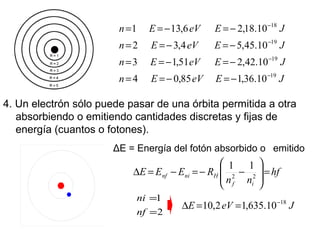
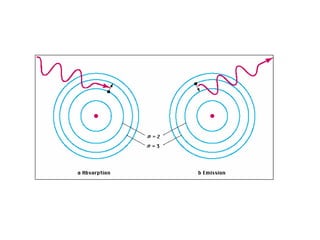
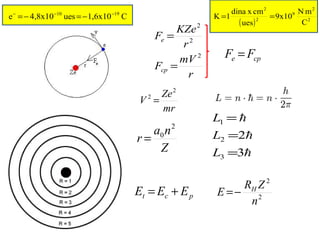
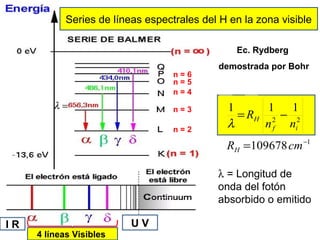
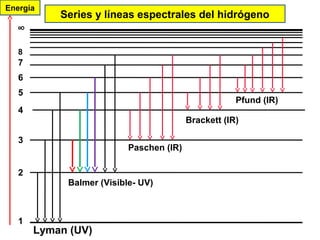
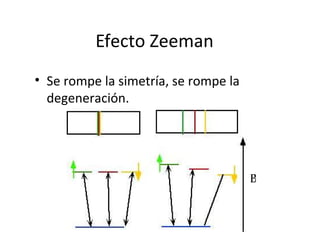
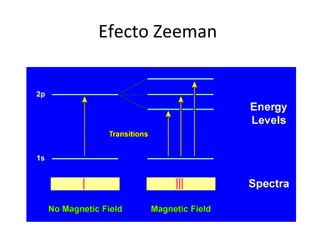
El documento presenta un resumen de la historia de la teoría atómica desde Dalton hasta Bohr. Comienza con las ideas de Dalton sobre los átomos y continúa explicando los descubrimientos de Thomson, Rutherford, Planck, Einstein y otros que llevaron al modelo atómico cuántico de Bohr en 1913.