El documento describe la holoprosencefalia (HPE), una malformación cerebral grave caracterizada por la división anormal del prosencéfalo. Existen varias formas de HPE en un espectro que va desde las más graves como la alobar hasta las más leves como la lobar. Además de estas formas clásicas, también se incluye la variante interhemisférica media. El pronóstico depende de la gravedad de las malformaciones cerebrales y faciales, la presencia de anomalías cromosómicas u otros órganos afect



![278 enero-febrero 2015 radiographics.rsna.org
HPE se considera la malformación más común del
cerebro y la cara en humanos (1). Existe la suposición
de una alta letalidad embrionaria/fetal en las formas
graves de HPE (26). Orioli y Castilla (27) revisaron 21
estudios epidemiológicos en los que las tasas de
prevalencia dependían de si los datos incluían nacidos
vivos, mortinatos o abortos. La prevalencia es de menos
de uno en 10 000 en los nacidos vivos y mortinatos,
mayor cuando se incluyen las interrupciones del embarazo
y hasta 50 por 10 000 en los embriones abortados (27).
No hay
Aunque el término fusión se usa para describir HPE, el
proceso real es de no escisión, en lugar de fusión activa
de estructuras emparejadas (16).
Se pueden observar muchas anomalías no
craneofaciales con HPE, siendo las más comunes los
defectos genitales (24 %), la polidactilia postaxial (8
%), los defectos vertebrales (5 %), los defectos por
reducción de las extremidades (4 %) y la transposición
de las grandes arterias. 4%) (27). Las anomalías
adicionales no necesariamente indican aneuploidía, porque ocurren en
fuerte predilección étnica. Se postula que una
preponderancia femenina al nacer es secundaria a una
mayor letalidad de HPE en los hombres. Los aumentos
en la tasa de prevalencia de nacimientos notificados
pueden ser causa de mejoras en el diagnóstico prenatal.
En un estudio estadounidense de 57 119 fetos entre 11
semanas 0 días y 13 semanas 6 días de gestación, se
determinó una prevalencia de encefalia holopros de uno
en 1298 (28).
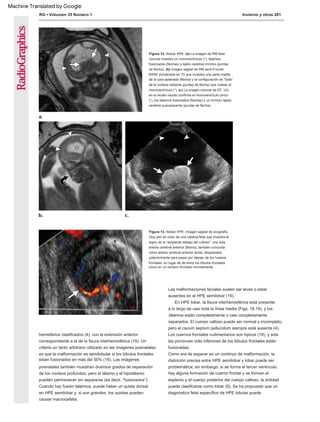
Figura 5. Imagen de US endovaginal coronal que muestra SOD en
un feto. La presencia del cuerpo calloso (punta de flecha) con
ausencia del cavum ayudó a identificar SOD, con confirmación
posnatal del diagnóstico.
Figura 6. Imagen de RM fetal axial de adquisición rápida de medio
Fourier ponderada en T2 con realce de relajación (RARE) que
muestra SOD. Se observa comunicación entre los cuernos frontales
con un cavum septum pellucidum (flecha) ausente. No se observó
otra normalidad ab.
Figura 4. Atelencefalia. (a) La imagen ultrasonográfica (US) transversal muestra una apariencia sin
rasgos distintivos sin una arquitectura cerebral identificable a las 21 semanas de edad gestacional. A =
anterior, P = posterior. (b) La muestra de autopsia confirma el diagnóstico de atelencefalia, con
formación del diencéfalo (flecha negra) únicamente y ausencia de estructuras telencefálicas. Están
presentes el cerebelo (puntas de flecha) y las estructuras del tronco encefálico (flecha blanca) normales.
(Figura 4b reproducida, con permiso, de Amirsys [Salt Lake City, Utah]).
Epidemiología
Machine Translated by Google](https://image.slidesharecdn.com/holoprosencefalia-230414071139-20002543/85/holoprosencefalia-pdf-4-320.jpg)
![Es imposible determinar un riesgo de recurrencia
preciso para HPE debido a su etiología multifactorial, pero
el riesgo es bajo si el feto es aneuploide; para obtener más
detalles sobre este tema complejo y de rápida evolución,
consulte Mercier et al (22).
A pesar de la utilidad comprobada de la detección
de mutaciones genéticas, casi el 75% de los casos de HPE
con cromosomas normales no tienen mutaciones
identificadas; por lo tanto, es probable que la patogenia de
HPE se deba a muchas causas adicionales no caracterizadas,
incluidos factores genéticos adicionales no identificados y
agentes ambientales (1); esto es de Muenke
Casi la mitad de los pacientes con HPE tienen un rec
HPE alobar En
HPE alobar, la escisión prosencefálica falla, lo que da
como resultado un prosencéfalo único en la línea media
con un monoventrículo primitivo a menudo asociado con un
gran quiste dorsal (9,16) (Figs. 7-13). El cerebro en HPE
alobar se puede describir como una bola, una copa o una
forma de panqueque sobre la base de la apariencia en las
vistas sagitales. En la forma de bola, que es la más común,
un volumen relativamente generoso de corteza cerebral rodea
por completo el monoventrículo. En la etapa intermedia, el
monoventrículo no está completamente rodeado y la corteza
restante tiene una configuración de "copa". En forma de
“panqueque”, el pequeño volumen de
síndrome reconocido o un defecto de un solo gen, pero se
sabe poco sobre los factores de riesgo para el resto con
HPE no sindrómico (40).
“hipótesis de múltiples aciertos” (9,36). El HPE no
cromosómico y no sindrómico se considera autosómico
dominante, con penetrancia incompleta y expresividad
marcadamente variable (21). Múltiples entidades autosómicas
recesivas están asociadas con HPE; estos incluyen el
síndrome de Smith-Lemli-Opitz (Herencia mendeliana en línea
en el hombre [OMIM] 270400), el síndrome de Meckel (OMIM
249000) y el síndrome de hidroletalidad (OMIM 236680)
(22,37).
Hay al menos 13 conocidos asociados a HPE
La diabetes materna (potencialmente aumentando
el riesgo 200 veces) (38), el alcohol etílico, el tabaquismo
y el ácido retinoico se han enumerado como posibles causas
de HPE (9,37,39), aunque la validez de varias de estas
asociaciones ha sido puesto en duda en un estudio de 2012
(40).
aproximadamente un tercio de los casos de HPE euploides
(29). Hay una miríada de otras asociaciones, incluidas
combinaciones inusuales como HPE con displasia tanatofórica
(30) y HPE con ectrodactilia (síndrome de Hartsfield) (31,32).
genes (21,33), pero no existe una correlación estricta
entre genotipo y fenotipo (22). La identificación de una
mutación específica responsable de HPE puede conferir
riesgos considerables de recurrencia (cerca del 20 %) en
una familia clínicamente normal (9,34). Una de las fuentes más
importantes de señales de ventralización durante el desarrollo
del cerebro anterior es el gen sonic hedgehog (1,35).
Etiología La
etiología del HPE es multifactorial: se han descrito anomalías
cromosómicas y genéticas, exposición a teratógenos y/o
asociación sindrómica. El cariotipo estándar encontrará una
anomalía cromosómica, clásicamente trisomía 13, en el 24%–
45% de todos los casos de HPE (22). Al menos el 10% de los
que tienen un cariotipo “normal” tienen microdeleciones o
duplicaciones que pueden detectarse con tecnología más
avanzada (27).
Invierno y otros 279
RG • Volumen 35 Número 1
Morfología de HPE
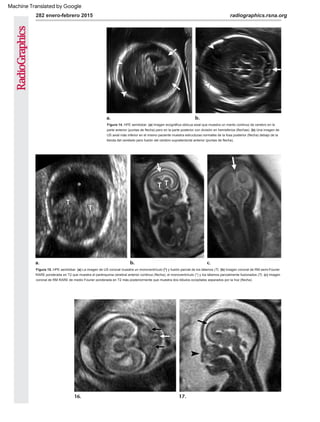
Figura 7. Alobar HPE. (a) La imagen de US axial oblicua obtenida a las 18 semanas muestra tálamos fusionados
(puntas de flecha) y un monoventrículo (*). (b) La ecografía axial oblicua obtenida a un nivel más alto muestra la
morfología en forma de copa de los hemisferios no hendidos (flechas) "ahuecando" el monoventrículo (*).
Machine Translated by Google](https://image.slidesharecdn.com/holoprosencefalia-230414071139-20002543/85/holoprosencefalia-pdf-5-320.jpg)


![Terminología relacionada
Ciclopía (ciclocefalia o sinoftalmía): erróneamente atribuido a la fusión de las órbitas, el ojo único es en realidad un problema
de desarrollo secundario a la falta de división del precursor primordial (26). El ojo en realidad puede estar ausente. No hay
una nariz verdadera; en cambio, normalmente se ve una probóscide (Fig. 22) por encima de la órbita. A menudo se observa
hipoplasia/aplasia de muchos de los huesos faciales, orejas de implantación baja y ausencia del filtrum. Cyclopia se asocia
con las formas más graves de HPE y ocurre en aproximadamente el 2% de los casos de HPE (52).
Labio leporino mediano: hendidura en la línea media asociada con la ausencia del filtrum (Fig. 25). También conocida como
agenesia premaxilar. Puede o no estar asociado con hipotelorismo o paladar hendido. Debe distinguirse del labio hendido
unilateral más común lateral al filtrum.
Arrinencefalia: Sinónimo obsoleto de HPE, ya no se usa o se usa para implicar la ausencia del lóbulo olfatorio del cerebro o
la ausencia variable de los bulbos olfatorios, los tractos y la sustancia perforante anterior sin fusión de los hemisferios
(50).
Proboscis (51): Usado por primera vez en inglés en 1609. Del latín proboscis, la latinización del griego proboskÿV (proboskis),
que proviene de prÿ (pro) “adelante, adelante, antes” y bÿskw (bosko), “alimentar , para nutrir."
Etmocefalia: hipotelorismo severo con una probóscide generalmente ubicada entre los ojos (Figs. 23, 24).
Cebocefalia (53): hipotelorismo (pero menos que en la etmocefalia [9]), pero con una nariz rudimentaria (a menudo una sola
fosa nasal) en una posición muy apropiada. La cebocefalia no suele asociarse con el labio hendido (15).
Esbozo medio del filtrum-premaxilar: Labio leporino lateral bilateral (Fig. 26) con un proceso mediano que representa el
esbozo del philtrum-premaxilar. Asociado con aplanamiento de la nariz.
El ejemplo clásico es la trompa del elefante.
La etimología describe una cabeza de mono, del griego kebos (mono) y kephale (cabeza).
Anomalías faciales (más a menos graves)
RG • Volumen 35 Número 1 Invierno et al 285
El plexo coroideo es angosto en el medio pero más grueso en
ambos extremos, y cuando se ven uno al lado del otro, las coroides
crean una apariencia de mariposa. La capacidad de demostrar
este signo dentro de una bóveda craneal normal es altamente
sugestiva de HPE (53).
Los individuos infectados tienen un fenotipo facial distinto, con
fisuras palpebrales inclinadas hacia arriba, estrechamiento
bitemporal, un filtrum ancho y distintivo, orejas grandes y una
nariz corta con narinas antevertidas (33).
El signo de la mariposa se puede ver de manera confiable
en una sección transversal del cerebro normal del primer trimestre.
El grupo del Harris Birthright Center (Londres, Inglaterra) ha
demostrado que en fetos con
Histológicamente, el diagnóstico se puede determinar a partir
de las 6 semanas 0 días desde la última menstruación o
estadio Carnegie 13 (11). Alobar HPE es una anomalía que se
puede diagnosticar con la ayuda de ecografía en el embrión en
desarrollo. Hay al menos dos informes de casos que describen el
diagnóstico prenatal de EE. UU.
antes de las 10 semanas de edad menstrual, e innumerables
reportes describen la detección entre las 10 y 14 semanas sobre
la base de morfología facial anormal (11) y ausencia del signo de
la “mariposa” (53).
¿Cuándo se
puede establecer el diagnóstico?
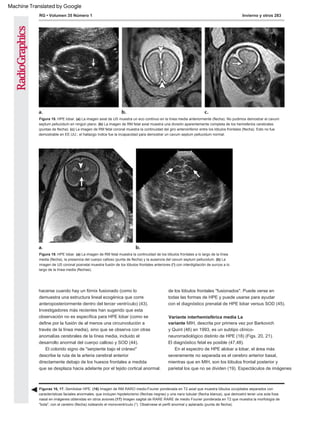
Figura 21. MIH. Las imágenes de RM ponderadas en T2 axial (a, b) y coronal (c) en un recién nacido diagnosticado prenatalmente con MIH muestran
una falta de separación en los lóbulos frontales posteriores (punta de flecha negra). Obsérvese también la apariencia anormal de las fisuras de Silvio
orientadas verticalmente (flechas en a y b), que se extienden más hacia la línea media de lo esperado, y la displasia cortical (punta de flecha blanca
en c) y la heterotopía de la sustancia gris (flecha en c).
Machine Translated by Google](https://image.slidesharecdn.com/holoprosencefalia-230414071139-20002543/85/holoprosencefalia-pdf-11-320.jpg)



![RG • Volumen 35 Número 1 Invierno et al 289
Referencias 1.
Roessler E, Muenke M. La genética molecular de la encefalia
holopros. Am J Med Genet C Semin Med Genet 2010;154C
(1):52–61.
35. Actualización de señalización de Cohen MM Jr. Hedgehog. Soy J Med Genet
45. Bernard JP, Drummond CL, Zaarour P, Molho M, Ville Y.
25. Barkovich AJ, Simon EM, Clegg NJ, Kinsman SL, Hahn JS. Análisis de la
corteza cerebral en holoprosencefalia con atención a las fisuras de Silvio.
AJNR Am J Neuroradiol 2002;23(1):143–150.
Semin Ultrasonido CT MR 2011;32(3):159–166.
8. Probst F. Prosencefalias: morfología, aspecto neurorradiológico y diagnóstico
diferencial. Berlín, Alemania: Springer Verlag, 1979.
14. Winter T. Holoprosencefalia semilobar. En: Woodward PJ, ed. Diagnóstico
por la imagen: obstetricia. 2ª ed. Altona, Manitoba, Canadá: Amirsys, 2011.
[ PubMed ] 19. Simon EM, Barkovich AJ. Holoprosencefalia: nuevos conceptos.
Magn Reson Imaging Clin N Am 2001;9(1):149–164, viii–ix.
31. Keaton AA, Solomon BD, van Essen AJ, et al. Holoprosen cefalia y
ectrodactilia: informe de tres nuevos pacientes y revisión de la literatura.
Am J Med Genet C Semin Med Genet 2010;154C(1):170–175.
[ PubMed ] 28. Kagan KO, Staboulidou I, Syngelaki A, Cruz J, Nicolaides KH. La
exploración de 11 a 13 semanas: diagnóstico y resultado de loprosencefalia,
exomphalos y megacystis. Ultrasonido Obstetricia Gynecol 2010;36(1):10–
14.
32. Metwalley Kalil KA, Fargalley HS. Holoprosencefalia en un bebé egipcio con
síndrome de ectrodactilia-displasia ectodérmica-fisura: informe de un caso.
J Med Case Reports 2012;6(1):35.
43. Pilu G, Ambrosetto P, Sandri F, et al. Arcos fusionados intraventriculares: un
signo específico de holoprosencefalia lobar fetal.
40. Vaz SS, Chodirker B, Prasad C, Seabrook JA, Chudley AE, Prasad AN.
Factores de riesgo para la cefalia holoprosen no sindrómica: un estudio de
casos y controles de Manitoba. Am J Med Genet A 2012;158A(4):751–758.
23. Shekdar K. Malformaciones de la fosa posterior. Ultrasonido Semin
5. DeMyer W, Zeman W. Holoprosencefalia de Alobar (encefalia de arhin)
con labio y paladar hendido mediano: consideraciones clínicas,
electroencefalográficas y nosológicas. Confin Neurol 1963;23:1–36.
38. Holoprosencefalia. Herencia mendeliana en línea en el hombre, OMIM.
Universidad Johns Hopkins, Baltimore, Md. Número MIM: 236100. http://
omim.org/entry/236100. Publicado el 17 de mayo de 2012. Consultado el
13 de febrero de 2014.
17. Li Y, Sansgiri RK, Estroff JA, et al. Resultado de los fetos con ventriculomegalia
cerebral y anomalías en las valvas del septum pellucidum. AJR Am J
Roentgenol 2011;196(1):
2. Cohen MM Jr. Holoprosencefalia: un destilado mitológico y teratológico.
Am J Med Genet C Semin Med Genet 2010; 154C(1):8–12.
A 2010;152A(8):1875–1914.
Una nueva pista para el diagnóstico prenatal de cefalia lobar holoprosen:
la vía anormal de la arteria cerebral anterior que se arrastra debajo del
cráneo. Ultrasonido Obstet Gynecol 2002; 19(6):605–607.
9. Volpe P, Campobasso G, De Robertis V, Rembouskos G.
15. Levey EB, Stashinko E, Clegg NJ, Delgado MR. Manejo de niños con
holoprosencefalia. Am J Med Genet C Semin Med Genet 2010;154C(1):183–
190.
20. Winter TC, Kennedy AM, Byrne J, Woodward PJ. El cavum septi pellucidi:
¿por qué es importante? J Ultrasonido Med 2010; 29(3):427–444.
6. DeMyer W, Zeman W, Palmer CG. Holoprosencefalia alobar familiar
(arrinencefalia) con labio y paladar hendido mediano: informe de un
paciente con 46 cromosomas. Neurología 1963; 13:913–918.
39. Stashinko EE, Clegg NJ, Kammann HA, et al. Una encuesta retrospectiva
de los factores de riesgo perinatal de 104 niños vivos con holoprosencefalia.
Am J Med Genet A 2004;128A(2):
W83–W92.
26. Shiota K, Yamada S. Patogénesis temprana de la holoprosencefalia.
11. Blaas HG, Eik-Nes SH. Sonoembriología y diagnóstico prenatal precoz de
anomalías neurales. Diagnóstico Prenat 2009;29(4):312–325.
CTMR 2011;32(3):228–241.
41. Kathuria S, Gregg L, Chen J, Gandhi D. Desarrollo arterial cerebral normal y
variaciones. Semin Ultrasonido CT MR 2011;32(3):242–251.
Trastornos del desarrollo prosencefálico. Diagnóstico Prenat 2009;29(4):340–
354.
16. Hahn JS, Barnes PD. Avances en neuroimagen en holoprosencefalia:
refinando el espectro de la malformación de la línea media. Am J Med
Genet C Semin Med Genet 2010; 154C(1):120–132.
21. Solomon BD, Mercier S, Vélez JI, et al. Análisis de correlaciones genotipo
fenotipo en holoprosencefalia humana. Am J Med Genet C Semin Med
Genet 2010;154C(1):133–141.
3. Homero. La Odisea de Homero. Nueva York, NY: Harper Perennial, 1999.
36. Ming JE, Muenke M. Múltiples impactos durante el desarrollo embrionario
temprano: enfermedades digénicas y holoprosencefalia. Soy J Hum Genet
2002;71(5):1017–1032.
29. Whiteford ML, Tolmie JL. Holoprosencefalia en el oeste de Escocia
1975-1994. J Med Genet 1996;33(7):578–584.
33. Itoh K, Ogi H, Yaoi T, et al. Holoprosencefalia semilobar con un surco de
Silvio atravesado único. Neuropathol Appl Neurobiol 2011;37(6):685–688.
Ultrasonido Obstet Gynecol 1994;4(1):65–67.
24. Encha-Razavi F, Gonzalès M, Laquerrière A, et al. Un enfoque práctico para
el examen del cerebro fetal malformado: impacto en el asesoramiento
genético. Patología 2008;40 (2):180–187.
7. DeMyer W, Zeman W, Palmer CG. La cara predice el cerebro: importancia
diagnóstica de las anomalías faciales medianas para la holoprosencefalia
(arrinencefalia). Pediatría 1964;34:256–263.
29–40.
18. Lewis AJ, Simon EM, Barkovich AJ, et al. Variante interhemisférica media
de holoprosencefalia: un subtipo clínico neurorradiológico distinto.
Neurología 2002;59(12):1860–1865.
46. Barkovich AJ, Quint DJ. Fusión interhemisférica media: una variante inusual
de holoprosencefalia. AJNR Am J Neuroradiol 1993;14(2):431–440.
Am J Med Genet C Semin Med Genet 2010;154C(1):22–28.
12. Hansen PE, Ballesteros MC, Soila K, García L, Howard JM. Imagen de
resonancia magnética del cerebro humano en desarrollo. I. Desarrollo
prenatal. RadioGraphics 1993;13(1):21–36.
42. Holoprosencefalia de Winter T. Alobar. En: Woodward PJ, ed.
10. Fotos J, Olson R, Kanekar S. Embriología del cerebro y genética molecular
de la malformación del sistema nervioso central.
114–119.
22. Mercier S, Dubourg C, Belleguic M, et al. Asesoramiento genético y
diagnóstico prenatal “molecular” de la holoprosencefalia (HPE). Am J Med
Genet C Semin Med Genet 2010; 154C(1):191–196.
[ PubMed ] 30. Martínez-Frías ML, Egues X, Puras A, et al. Displasia tanatofórica
tipo II con encefalocele y encefalia semilobar holopros: información sobre
su patogenia. Am J Med Genet A 2011;155A(1):197–202.
34. David AL, Gowda V, Turnbull C, Chitty LS. El riesgo de recurrencia de
holoprosencefalia en fetos euploides. Obstet Gynecol 2007;110(3):658–662.
44. Deer E, Nelson C, Moore K, Kennedy A. OP14.04: fondos de saco fusionados:
hallazgos del SNC y resultado en 30 casos fetales. Ultrasonido Obstet
Gynecol 2011;38(suppl 1):95.
27. Orioli IM, Castilla EE. Epidemiología de la holoprosencefalia: prevalencia y
factores de riesgo. Am J Med Genet C Semin Med Genet 2010;154C(1):13–
21.
13. Bardo D. Neurorradiología pediátrica. I. Bases embriológicas de las
malformaciones cerebrales. Appl Radiol 2009 (julio-agosto):
Diagnóstico por la imagen: obstetricia. 2ª ed. Altona, Manitoba, Canadá:
Amirsys, 2011.
4. Marcorelles P, Laquerriere A. Neuropathology of holoprosen cephaly. Am
J Med Genet C Semin Med Genet 2010;154C (1):109–119.
37. Mighell AS, Johnstone ED, Levene M. Investigaciones posnatales: manejo
y pronóstico de fetos con anomalías del SNC identificadas en el útero,
excluyendo problemas neuroquirúrgicos. Diagnóstico Prenat 2009;29(4):442–
449.
47. Pulitzer SB, Simon EM, Crombleholme TM, Golden JA. Hallazgos de RM
prenatales de la variante interhemisférica media de holoprosencefalia.
AJNR Am J Neuroradiol 2004;25(6):1034–1036.
Machine Translated by Google](https://image.slidesharecdn.com/holoprosencefalia-230414071139-20002543/85/holoprosencefalia-pdf-15-320.jpg)
