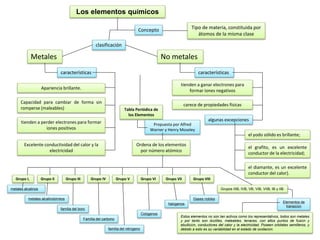
Este documento describe los elementos químicos y su clasificación. Explica que los elementos se clasifican como metales o no metales dependiendo de sus propiedades físicas. También describe la tabla periódica de los elementos, la cual ordena los elementos por número atómico y agrupa elementos con propiedades similares. Finalmente, explica cómo varias propiedades atómicas como el radio atómico, la energía de ionización y la electronegatividad cambian periódicamente a través de la tabla.