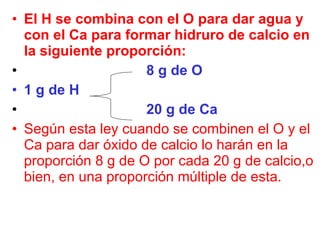
Este documento habla sobre la materia y sus propiedades. Define la materia y explica sus transformaciones físicas y químicas. También describe las sustancias puras como elementos y compuestos, y las mezclas como homogéneas y heterogéneas. Finalmente, presenta las leyes ponderales como la conservación de la masa y las proporciones definidas, múltiples y recíprocas.