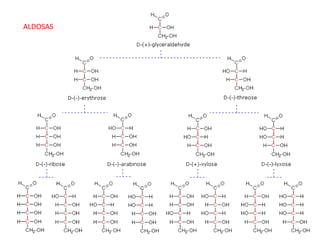
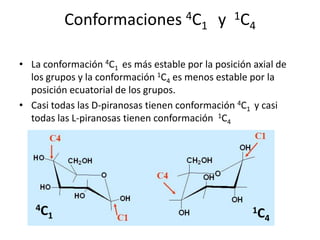
Este documento describe la estructura de los monosacáridos. Explica que los monosacáridos forman anillos cíclicos de 5 o 6 miembros a través de enlaces hemiacétales. La glucosa forma un anillo de 6 miembros (piranosa) con el grupo hidroxilo del carbono 1 en posición axial o ecuatorial, dando lugar a los anómeros alfa y beta respectivamente. El anómero alfa es más estable debido al efecto anomérico, que implica una interacción orbital entre el