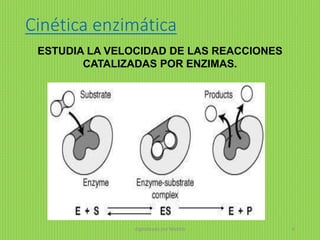
- El documento describe el modelo cinético de Michaelis-Menten para la cinética enzimática. Según este modelo, las enzimas catalizan reacciones a través de la formación de un complejo enzima-sustrato de manera temporal.
- La velocidad de la reacción está dada por la ecuación de Michaelis-Menten, la cual depende de dos parámetros: la velocidad máxima (Vmax) y la constante de Michaelis (KM).
- La Vmax representa la velocidad cuando todos los sitios activos de


![CINETICA QUIMICA
Es el estudio de la velocidad de cambio entre el estado inicial de los
reactivos y productos y su estado final.
EXPRESIONES DE LAS VELOCIDADES DE LAS REACCIONES QUIMICAS
De acuerdo al número de moléculas que reaccionan:
a) Monomoléculas
b) Bimoleculas
c) Trimoleculares
Dependiendo de la Influencia de la Concentración de los reaccionantes
sobre velocidad
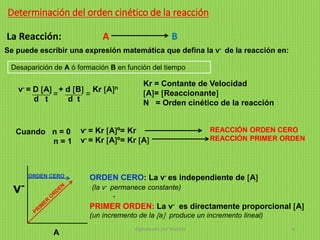
•Reacciones 1º orden: Tienen lugar a una v- es proporcional a la ] de Reactantes.
•Reacciones 2º orden: La v- es proporcional al producto de los dos Reaccionantes.
•Reacciones 3º orden: La v- es proporcional al producto de los tres Reaccionantes.
•Reacciones orden Cero: Cuando son independientes de la concentración de
cualquier reactivo. *La v- depende de la E ?
digitalizado por Melilds 3](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-3-320.jpg)

![De esta forma, la medida de v0 se realiza antes de que se consuma el 10% del total
del sustrato, de forma que pueda considerarse la [S] como esencialmente
constante a lo largo del experimento. Además, en estas condiciones no es
necesario considerar la reacción inversa, ya que la cantidad de producto formada
es tan pequeña que la reacción inversa apenas ocurre. De esta forma se
simplifican enormemente las ecuaciones de velocidad.
A medida que la reacción transcurre, la
velocidad de acumulación del producto va
disminuyendo porque se va consumiendo el
sustrato de la reacción (Figura de la
derecha). Para evitar esta complicación se
procede a medir la velocidad inicial de la
reacción (v0).
La velocidad inicial de la reacción es igual a
la pendiente de la curva de avance a tiempo
cero.
digitalizado por Melilds 8](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-8-320.jpg)
![Para explicar la relación oservada entre la velocidad inicial
(v0) y la concentración inicial de sustrato ([S]0) Michaelis y
Menten propusieron que las reacciones catalizadas
enzimáticamente ocurren en dos etapas:
En la primera etapa se forma el complejo enzima-sustrato
y en la segunda, el complejo enzima-sustrato da lugar a la
formación del producto, liberando el enzima libre:
digitalizado por Melilds 9](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-9-320.jpg)



![A concentraciones de sustrato pequeñas ([S] << KM) v = (k3 [ET]/KM) [S].
Como los términos entre paréntesis son constantes, pueden englobarse en una
nueva constante, kobs, de forma que la expresión queda reducida a: v = kobs [S],
con lo cual la reacción es un proceso cinético de primer orden.
Para cualquier reacción enzimática, [ET], k3 y KM son constantes. Vamos a
considerar dos casos extremos:
[S] << km
V= Vmax [S]
km + [S]
V= K. [S]
digitalizado por Melilds 15](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-15-320.jpg)
![A concentraciones de sustrato elevadas ([S] >> KM), v = k3 [ET].
La velocidad de reacción es independiente de la concentración del
sustrato, y por tanto, la reacción es un proceso cinético de orden cero.
Además, tanto k3 como [ET] son constantes, y nos permite definir un
nuevo parámetro, la velocidad máxima de la reacción (Vmax): Vmax = k3
[ET], que es la velocidad que se alcanzaría cuando todo el enzima
disponible se encuentra unido al sustrato.
[S] << km
V= Vmax [S]
km + [S]
V= Vmax [S]
[S]
V= Vmax
Si introducimos el parámetro de Vmax en la ecuación
general de la velocidad, (la fórmula recuadrada
anteriormente), obtenemos la expresión más conocida
de la ecuación de Michaelis – Menten:
V = Vmax [S]
km + [S]
digitalizado por Melilds 16](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-16-320.jpg)
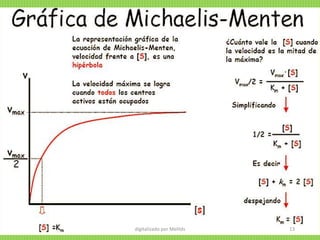
![CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA
La representación gráfica de la ecuación de Michaelis-
Menten (v0 frente a [S]0) es una hipérbola. La Vmax
corresponde al valor máximo al que tiende la curva
experimental, y la KM corresponde a la concentración de
sustrato a la cual la velocidad de la reacción es la mitad
de la Vmax. digitalizado por Melilds 17](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-17-320.jpg)



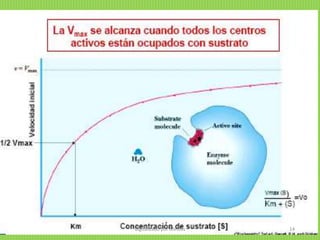
![Vo= Vmax Todos los sitios activos están ocupados y no
hay moléculas de E libre.
KM= [S] Sí... ½ Vmax
KM representa la cantidad de sustrato necesaria para
fijarse a la mitad de la E disponible y producir la mitad
de la Vmax
KM representa la concentración del sustrato en una
célula
digitalizado por Melilds 21](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-21-320.jpg)
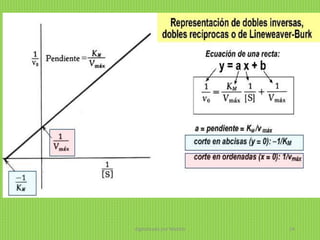
![Para determinar gráficamente los
valores de KM y Vmax es más sencillo
utilizar la representación doble
recíproca (1/v0 frente a 1/[S]0), ya que
es una línea recta. Esta representación
doble recíproca recibe el nombre de
representación de Lineweaver-Burk .
REPRESENTACIÓN DE LINEWEAVER - BURK
Es una recta en la cual:
La pendiente es KM/Vmax
La abscisa en el origen (1/v0 = 0) es -1/KM
La ordenada en el origen (1/[S]0 = 0) es 1/Vmax
De esta forma, a partir de los datos experimentales se puede calcular gráficamente, los
valores de KM y Vmax de un enzima para diversos sustratos.
digitalizado por Melilds 22](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-22-320.jpg)
![Se usan las reciprocas de la V y [S]
• V = [S]Vmax
Km + [S]
• 1= Km + [S]
V V max. [S]
Ordenando:
• 1 = Km + [S]
V Vmax. [S] V max. [S]
• 1 = Km • 1 + 1
V Vmax [S] Vmax
y = a x b digitalizado por Melilds 23](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-23-320.jpg)
![RESUMEN
• El modelo de Michaelis Menten da cuenta de las
Propiedades Cinéticas de las Enzimas
E + S K2
k1 ES K3 E + P
• La velocidad (V) de la formación de producto está dada
por la ecuación de M.M.
V= Vmax [S]
[S] + km
digitalizado por Melilds 25](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-25-320.jpg)

![• La velocidad maxima, Vmax, es igual al producto de
K3 y la concentración total de la Enzima
Vmax = K3 [Et]
K3: es el número de moléculas de S convertidas en P
por unidad de tiempo por un solo centro catalítico
cuando la E está completamente saturado con S
digitalizado por Melilds 27](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-27-320.jpg)





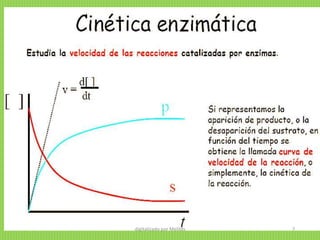
![Al seguir la velocidad de aparición de producto (o de desaparición del sustrato) en
función del tiempo se obtiene la llamada curva de avance de la reacción, o
simplemente, la cinética de la reacción.
De esta forma, la medida de v0 se realiza antes de que se consuma el 10% del total
del sustrato, de forma que pueda considerarse la [S] como esencialmente
constante a lo largo del experimento. Además, en estas condiciones no es
necesario considerar la reacción inversa, ya que la cantidad de producto formada
es tan pequeña que la reacción inversa apenas ocurre. De esta forma se
simplifican enormemente las ecuaciones de velocidad.
A medida que la reacción transcurre, la
velocidad de acumulación del producto va
disminuyendo porque se va consumiendo el
sustrato de la reacción (Figura de la derecha).
Para evitar esta complicación se procede a
medir la velocidad inicial de la reacción (v0).
La velocidad inicial de la reacción es igual a la
pendiente de la curva de avance a tiempo
cero.
digitalizado por Melilds 33](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-33-320.jpg)
![Para estudiar la cinética enzimática se mide el efecto de
la concentración inicial de sustrato sobre la velocidad
inicial de la reacción, manteniendo la cantidad de
enzima constante. Si representamos v0 frente a [S]0
obtenemos una gráfica como la de la Figura de la
derecha.
Cuando [S]0 es pequeña, la velocidad
inicial es directamente proporcional a
la concentración de sustrato, y por
tanto, la reacción es de primer orden.
A altas [S]0, el enzima se encuentra
saturada por el sustrato, y la
velocidad ya no depende de [S]0. En
este punto, la reacción es de orden
cero y la velocidad es máxima (Vmax).
digitalizado por Melilds 34](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-34-320.jpg)
![Para explicar la relación oservada entre la
velocidad inicial (v0) y la concentración inicial de
sustrato ([S]0) Michaelis y Menten propusieron que
las reacciones catalizadas enzimáticamente
ocurren en dos etapas: En la primera etapa se
forma el complejo enzima-sustrato y en la
segunda, el complejo enzima-sustrato da lugar a la
formación del producto, liberando el enzima libre:
digitalizado por Melilds 35](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-35-320.jpg)
![En este esquema, k1, k2 y k3 son las constantes cinéticas
individuales de cada proceso y también reciben el nombre de
constantes microscópicas de velocidad. Según esto, podemos
afirmar que:
v1 = k1 [E] [S]
v2 = k2 [ES]
v3 = k3 [ES]
Se puede distinguir entre enzima libre (E) y enzima unido al
sustrato (ES), de forma que la concentración total de enzima,
[ET], (que es constante a lo largo de la reacción) es:
[ET] = [E] + [ES]
Como [E] = [ET] - [ES], resulta que: v1= k1[S] [ET] - k1 [S] [ES]
digitalizado por Melilds 36](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-36-320.jpg)
![Este modelo cinético adopta la hipótesis del estado estacionario, según la cual
la concentración del complejo enzima-sustrato es pequeña y constante a lo largo
de la reacción (Figura de la derecha). Por tanto, la velocidad de formación del
complejo enzima-sustrato (v1) es igual a la de su disociación (v2+ v3):
v1 = v2 + v3
Además, como [ES] es constante, la velocidad de formación de los productos es
constante:
v = v3 = k3 [ES] = constante.
Como v1=v2+v3, podemos decir que:
k1[S] [ET] - k1 [S] [ES] = k2 [ES] + k3 [ES]
Despejando [ES], queda que:
, siendo
digitalizado por Melilds 37](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-37-320.jpg)
![En donde la expresión (k2+k3)/k1 se ha sustituído por KM, o
constante de Michaelis-Menten. Este enlace nos aporta una
explicación sobre las razones que hacen de la KM un parámetro
cinético importante.
Por lo tanto, en el estado estacionario, la velocidad de
formación del producto es:
v = v3 = k3 [ES] =
digitalizado por Melilds 38](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-38-320.jpg)
![A concentraciones de sustrato pequeñas ([S] << KM) v = (k3 [ET]/KM) [S].
Como los términos entre paréntesis son constantes, pueden englobarse en una
nueva constante, kobs, de forma que la expresión queda reducida a: v = kobs [S],
con lo cual la reacción es un proceso cinético de primer orden.
Para cualquier reacción enzimática, [ET], k3 y KM son constantes. Vamos a
considerar dos casos extremos:
[S] << km
V= Vmax [S]
km + [S]
V= K. [S]
digitalizado por Melilds 39](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-39-320.jpg)
![A concentraciones de sustrato elevadas ([S] >> KM), v = k3 [ET]. La
velocidad de reacción es independiente de la concentración del
sustrato, y por tanto, la reacción es un proceso cinético de orden
cero. Además, tanto k3 como [ET] son constantes, y nos permite
definir un nuevo parámetro, la velocidad máxima de la reacción
(Vmax): Vmax = k3 [ET], que es la velocidad que se alcanzaría cuando
todo el enzima disponible se encuentra unido al sustrato.
[S] << km
V= Vmax [S]
km + [S]
V= Vmax [S]
[S]
V= Vmax
Si introducimos el parámetro de Vmax en la ecuación
general de la velocidad, (la fórmula recuadrada
anteriormente), obtenemos la expresión más conocida
de la ecuación de Michaelis – Menten:
V = Vmax [S]
km + [S]
digitalizado por Melilds 40](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-40-320.jpg)
![CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA
La representación gráfica de la ecuación de Michaelis-
Menten (v0 frente a [S]0) es una hipérbola (Figura de la
izquierda). La Vmax corresponde al valor máximo al que
tiende la curva experimental, y la KM corresponde a la
concentración de sustrato a la cual la velocidad de la
reacción es la mitad de la Vmax.digitalizado por Melilds 41](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-41-320.jpg)

![Para determinar gráficamente los
valores de KM y Vmax es más sencillo
utilizar la representación doble
recíproca (1/v0 frente a 1/[S]0), ya que
es una línea recta. Esta representación
doble recíproca recibe el nombre de
representación de Lineweaver-Burk .
REPRESENTACIÓN DE LINEWEAVER - BURK
Es una recta en la cual:
La pendiente es KM/Vmax
La abscisa en el origen (1/v0 = 0) es -1/KM
La ordenada en el origen (1/[S]0 = 0) es 1/Vmax
De esta forma, a partir de los datos experimentales se puede calcular gráficamente, los
valores de KM y Vmax de un enzima para diversos sustratos.
digitalizado por Melilds 43](https://image.slidesharecdn.com/1-150910042552-lva1-app6892/85/ENZIMAS-cinetica-enzimatica-43-320.jpg)