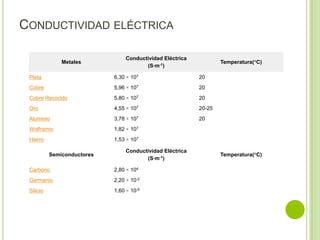
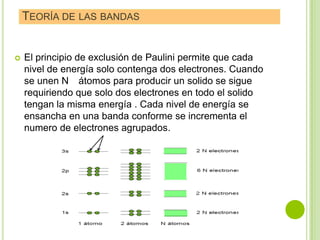
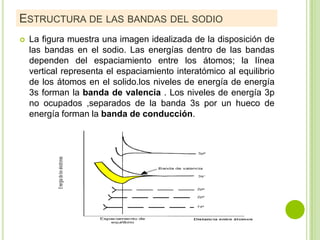
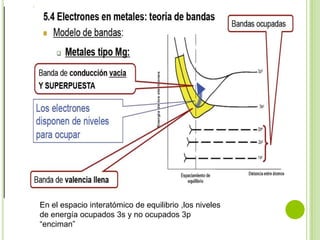
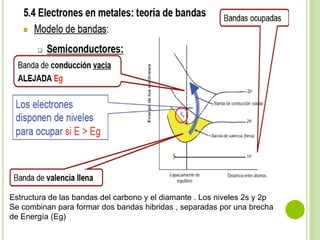
El documento describe las propiedades de los materiales y su conductividad eléctrica. Explica la ley de Ohm y cómo la resistencia de un material depende de su longitud, área y resistividad. Luego discute cómo la conductividad eléctrica varía entre metales, semiconductores y aislantes dependiendo de su estructura de bandas. También cubre cómo se puede controlar la conductividad de los metales y el fenómeno de la superconductividad.