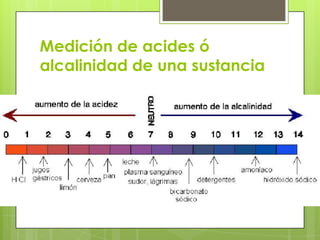
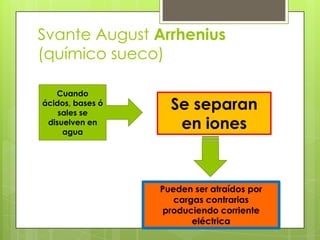
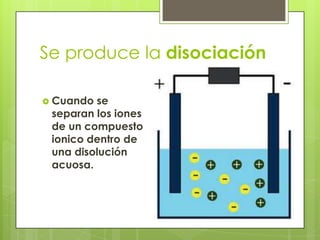
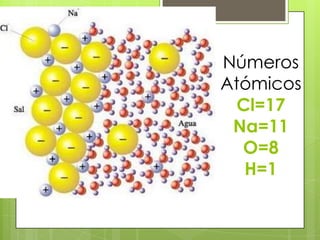
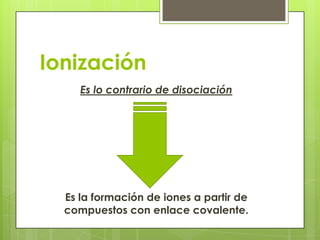
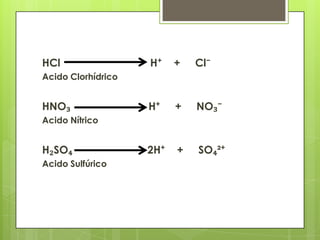
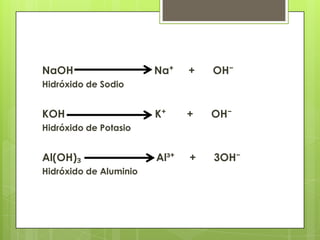
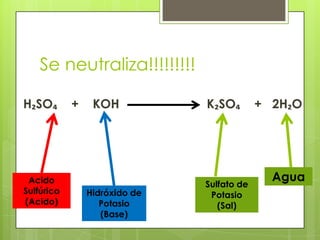
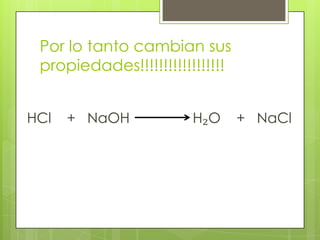
Este documento describe la teoría de ácidos y bases según el químico sueco Svante Arrhenius. Explica que Arrhenius definió los ácidos como sustancias que se disocian en iones hidrógeno cuando se disuelven en agua, y las bases como sustancias que forman iones hidroxilo al disolverse. También proporciona ejemplos como el ácido clorhídrico que se disocia en iones hidrógeno y cloruro, y la reacción neutralizante entre un ácido y una