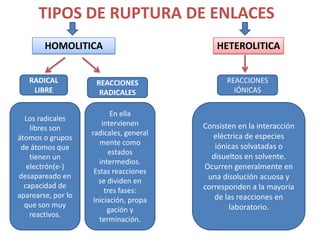
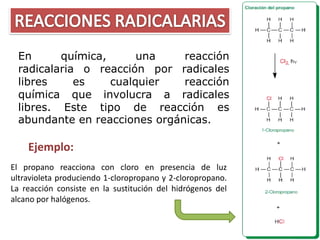
Este documento presenta información sobre diferentes tipos de ruptura de enlaces químicos, incluyendo ruptura homolítica, heterolítica, reacciones radicales, iónicas y concertadas. También define términos clave como radicales libres, reactivos nucleófilos y electrófilos.